题目内容
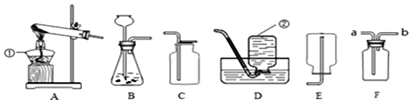
【题目】(1)来到展台②,看到熟悉的元素周期表,同学们立即想到了编制出元素周期表的科学家是:__________(填字母序号)。
A.道尔顿 B.卡文迪许 C.拉瓦锡 D.门捷列夫
依据图②中显示的信息继续回答。

(2)氯的相对原子质量为_________,氯原子的原子结构示意图为_________。
(3)镁元素是核电荷数为______的一类原子的总称。镁原子的结构示意图为![]() 在化学反应中易______(填“得”或“失”)电子,离子符号为______。
在化学反应中易______(填“得”或“失”)电子,离子符号为______。
(4)氯化镁(MgCl2)是由________(填“分子”、“原子”或“离子”,下同)构成的,氯气(Cl2)由_____构成,镁是由____构成。
(5)写出图②中一种元素的单质与氧气反应的符号表达式_______。
【答案】D 35.45 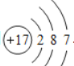 12 失 Mg2+ 离子 分子 原子 2Mg + O2
12 失 Mg2+ 离子 分子 原子 2Mg + O2 ![]() 2MgO
2MgO
【解析】
(1)根据科学家们各自在科学上做出的贡献进行分析解答;
(2)根据元素周期表的信息和核外电子排布规律进行分析解答;
(3)根据元素的概念和原子结构示意图的各部分的意义分析解答;
(4)常见物质的微粒构成进行分析;
(5)根据镁和氧气点燃生成氧化镁进行分析。
(1)A、道尔顿在化学上的主要贡献是提出了原子学说,故A错误;B、卡文迪许研究了空气的组成,发现普通空气中氮气占五分之四,氧气占五分之一。他确定了水的成分,肯定了它不是元素而是化合物。他还发现了硝酸,故B错误;C、拉瓦锡首先通过实验得出空气是由氮气和氧气组成的结论,故C错误;D、门捷列夫在化学上的主要贡献是发现了元素周期律,并编制出元素周期表,故D正确。故选D;
(2)根据元素周期表一格信息可知,氯的相对原子质量为35.45,氯元素的原子序数为17,在数值上原子序数等于质子数,在原子中,质子数=核外电子数,氯原子的核外电子数为17,根据原子核外电子排布的规律可知,第1层排布2个电子,第2层排布8个电子,第3层排布7个电子,氯原子的原子结构示意图为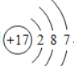 ;
;
(3)元素是具有相同核电荷数(即核内质子数)的一类原子的总称。镁元素是核电荷数为12的一类原子的总称。根据镁原子的结构示意图可知,镁原子的最外层电子数为2,少于4个, 在化学反应中易失电子,形成带2个单位正电荷的阳离子,离子符号为Mg2+;
(4)含有金属元素和非金属元素的化合物一般是由离子构成,氯化镁(MgCl2)是由离子构成的,气态的非金属单质(除稀有气体)一般是由分子构成,氯气(Cl2)由分子构成,金属、大多数固态非金属单质、稀有气体等由原子构成,镁是金属单质,镁是由原子构成。
(5)写出图②中镁与氧气反应生成氧化镁,符号表达式为Mg+O2![]() MgO。
MgO。

 阅读快车系列答案
阅读快车系列答案