题目内容
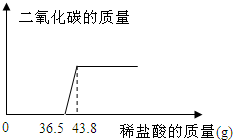
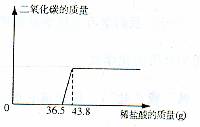
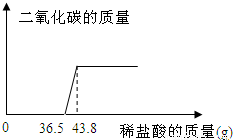
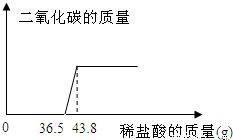
欲测定某一部分变质为碳酸钠的氢氧化钠固体中氢氧化钠的含量,小明同学取该样品5.06g放于烧杯中,向其中滴加10%的稀盐酸,所加稀盐酸和产生的气体的质量关系如图: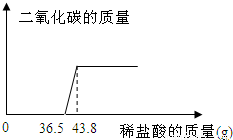
(1)求反应完毕后产生二氧化碳的质量.
(2)原固体中氢氧化钠的质量分数是多少?(结果精确至0.1%)
【答案】分析:首先可以根据图象判断出稀盐酸先和氢氧化钠反应,再和碳酸钠反应,以及这两种物质分别消耗的稀盐酸的质量,然后根据稀盐酸中氯化氢的质量就可以求出生成的二氧化碳的质量和原固体中碳酸钠的质量.
解答:解:设反应完毕后产生二氧化碳的质量为x,样品中碳酸钠的质量为y.
与Na2CO3反应的HCl质量为(43.8-36.5)g×10%=0.73g
2HCl+Na2CO3=2NaCl+H2O+CO2↑
73 106 44
0.73g y x
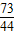 =
=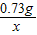 x=
x=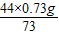 =0.44g
=0.44g
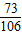 =
=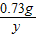 y=
y=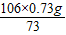 =1.06g
=1.06g
原混合物中氢氧化钠的质量分数是: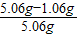 ×100%=79.1%
×100%=79.1%
答:(1)反应后生成的二氧化碳的质量为0.44g
(2)原固体中氢氧化钠的质量分数为79.1%
点评:本题难度不是很大,主要考查了质量守恒定律的应用和根据化学方程式的计算,培养学生分析问题的能力和解决问题的能力.
解答:解:设反应完毕后产生二氧化碳的质量为x,样品中碳酸钠的质量为y.
与Na2CO3反应的HCl质量为(43.8-36.5)g×10%=0.73g
2HCl+Na2CO3=2NaCl+H2O+CO2↑
73 106 44
0.73g y x
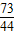 =
=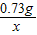 x=
x=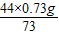 =0.44g
=0.44g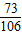 =
=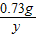 y=
y=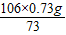 =1.06g
=1.06g原混合物中氢氧化钠的质量分数是:
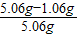 ×100%=79.1%
×100%=79.1%答:(1)反应后生成的二氧化碳的质量为0.44g
(2)原固体中氢氧化钠的质量分数为79.1%
点评:本题难度不是很大,主要考查了质量守恒定律的应用和根据化学方程式的计算,培养学生分析问题的能力和解决问题的能力.

练习册系列答案
相关题目