题目内容
【题目】某小组同学进行一氧化碳还原氧化铜实验并探究实验中进入C中的气体(装置气密性良好):
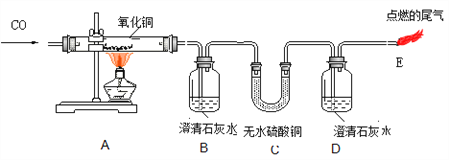
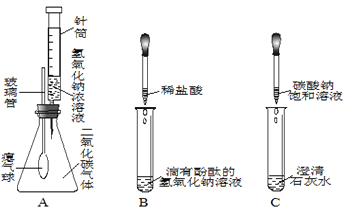
① 实验开始时,先_______(选填“通CO”或“加热”),目的是_______。A中反应的化学方程式_______,其中氧化剂是_______。
② 反应一段时间后,A中玻璃管内固体减少的质量_______(选填“>”、“<”、“=”)B中增加的质量。
③ 探究进入C中气体,甲同学认为是CO、H2O,乙同学认为是CO2、CO,你认为还可能是_________。
若甲同学的结论正确,除了E处有火焰,还依据的实验现象是________。
Ⅰ.A中固体变红 Ⅱ.B中石灰水变浑浊 Ⅲ.C中固体变蓝 Ⅳ.D中石灰水无变化
【答案】通 CO排尽装置内的空气,防止加热发生爆炸CO+CuO△Cu+CO2氧化铜(CuO)<H2O、CO、CO2Ⅲ、Ⅳ(答对一个得一分)
【解析】该反应为一氧化碳还原氧化铜的反应。①一氧化碳若混有了容器内的空气在加热使温度达到着火点,易引发爆炸,由此需先通一氧化碳将容器内的空气排净以免爆炸;A中为一氧化碳和氧化铜加热生成二氧化碳和铜;反应中提供氧元素的物质为氧化剂,由此氧化铜将氧元素提供给一氧化碳,为氧化剂;②A中氧化铜反应后变为铜,氧元素失去,质量减少;③对比甲乙,水和二氧化碳为变量,由此丙可以是一氧化碳和2种变量二氧化碳和水都有,即一氧化碳未完全反应,二氧化碳未完全被吸收,水蒸气从B中携带出来;E处有火焰证明有一氧化碳,那么C中无水硫酸铜变蓝说明有水,D中石灰水无明显变化说明无二氧化碳,综上,选Ⅲ、Ⅳ。

练习册系列答案
相关题目