题目内容
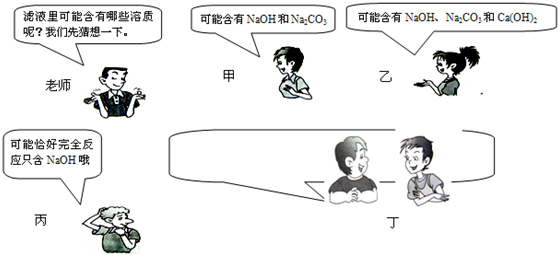
学习碳酸钠知识时,老师做碳酸钠溶液和澄清石灰水反应演示实验,并对浑浊液过滤,得到澄清滤液.课堂上老师的提问和同学们的回答如图所示:
(1)写出碳酸钠溶液和澄清石灰水反应的化学方程式:
(2)甲同学针对自己的猜想进行了如下实验:
(3)你认为乙同学的猜想都合理吗?如有不合理的请说明理由
(4)假设你是丁同学,请你也提出一个与甲、乙、丙同学不同的猜想,把猜想写在对话框中.并对你自己的猜想设计一个简单的实验加以证明.

(1)写出碳酸钠溶液和澄清石灰水反应的化学方程式:
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
.(2)甲同学针对自己的猜想进行了如下实验:
| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中,滴入过量稀盐酸 | 滴加一段时间后慢慢有气泡冒出 滴加一段时间后慢慢有气泡冒出 |
甲的猜想成立,化学方程式: Na2CO3+2HCl=2NaCl+H2O+C02↑ Na2CO3+2HCl=2NaCl+H2O+C02↑ |
Na2CO3与Ca(OH)2要发生反应,不可能共存.
Na2CO3与Ca(OH)2要发生反应,不可能共存.
.(4)假设你是丁同学,请你也提出一个与甲、乙、丙同学不同的猜想,把猜想写在对话框中.并对你自己的猜想设计一个简单的实验加以证明.
| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中, 通入足量的二氧化碳气体 通入足量的二氧化碳气体 |
试管中出现白色浑浊 试管中出现白色浑浊 |
自己的猜想成立 |
分析:(1)碳酸钠溶液和澄清石灰水反应生成碳酸钙(白色沉淀)和氢氧化钠;
(2)碳酸钠与盐酸反应可放出气体二氧化碳,但若溶液中存在氢氧化钠时,产生的少量气体二氧化碳又会被溶液中氢氧化钠吸收,而观察不到有气体放出的现象,因此,此时需要加入较多量的稀盐酸.
(3)碳酸钠和氢氧化钙不能共存;
(4)利用对碳酸钠和澄清石灰水完全反应生成物的认识,及不完全反应的碳酸钠过量或澄清石灰水过量的情况进行分析,得出物质存在的可能,完成对物质组成的猜想;利用氢氧化钙与氢氧化钠性质或变化规律的不同,选取适当的物质设计实验证明溶液中氢氧化钙的存在.
(2)碳酸钠与盐酸反应可放出气体二氧化碳,但若溶液中存在氢氧化钠时,产生的少量气体二氧化碳又会被溶液中氢氧化钠吸收,而观察不到有气体放出的现象,因此,此时需要加入较多量的稀盐酸.
(3)碳酸钠和氢氧化钙不能共存;
(4)利用对碳酸钠和澄清石灰水完全反应生成物的认识,及不完全反应的碳酸钠过量或澄清石灰水过量的情况进行分析,得出物质存在的可能,完成对物质组成的猜想;利用氢氧化钙与氢氧化钠性质或变化规律的不同,选取适当的物质设计实验证明溶液中氢氧化钙的存在.
解答:解:(1)碳酸钠溶液和澄清石灰水反应生成碳酸钙(白色沉淀)和氢氧化钠.其化学方程式:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
故答案是:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(2)向氢氧化钠溶液与碳酸钠溶液的混合溶液中滴加少量稀盐酸时,稀盐酸与碳酸钠反应产生二氧化碳气体,但是少量的二氧化碳气体会被氢氧化钠吸收,所以滴入足量稀盐酸时,一开始不会看到气泡冒出,需要滴加一段时间后慢慢有气泡冒出.
故答案是:
(3)乙同学的猜想不合理,因为Na2CO3与Ca(OH)2会发生反应,不可能共存.
故答案是:Na2CO3与Ca(OH)2要发生反应,不可能共存.
(4)碳酸钠溶液和澄清石灰水发生反应,若恰好完全反应,所得溶液为氢氧化钠溶液;若反应中碳酸钠有剩余,所得溶液则为氢氧化钠溶液与碳酸钠溶液的混合溶液;若反应中氢氧化钙溶液有剩余,所得溶液则为氢氧化钠溶液与氢氧化钙的混合溶液,所以,我的猜想为:氢氧化钠溶液与氢氧化钙溶液的混合物;氢氧化钠和氢氧化钙同属于碱,其化学性质很相似,但在发生反应时所现象的现象却因金属离子的不同而不同;如与气体二氧化碳反应时,氢氧化钙能形成沉淀而氢氧化钠与二氧化碳因生成可溶性的碳酸钠而无明显现象;利用变化时现象的不同,可证明氢氧化钙的存在;
故答案为:
写在对话框中猜想:可能含有 NaOH 和 Ca(OH)2 (填化学式)
故答案是:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(2)向氢氧化钠溶液与碳酸钠溶液的混合溶液中滴加少量稀盐酸时,稀盐酸与碳酸钠反应产生二氧化碳气体,但是少量的二氧化碳气体会被氢氧化钠吸收,所以滴入足量稀盐酸时,一开始不会看到气泡冒出,需要滴加一段时间后慢慢有气泡冒出.
故答案是:
| 实验现象 | 实验结论 |
| 滴加一段时间后慢慢有气泡冒出 | Na2CO3+2HCl=2NaCl+H2O+C02↑ |
故答案是:Na2CO3与Ca(OH)2要发生反应,不可能共存.
(4)碳酸钠溶液和澄清石灰水发生反应,若恰好完全反应,所得溶液为氢氧化钠溶液;若反应中碳酸钠有剩余,所得溶液则为氢氧化钠溶液与碳酸钠溶液的混合溶液;若反应中氢氧化钙溶液有剩余,所得溶液则为氢氧化钠溶液与氢氧化钙的混合溶液,所以,我的猜想为:氢氧化钠溶液与氢氧化钙溶液的混合物;氢氧化钠和氢氧化钙同属于碱,其化学性质很相似,但在发生反应时所现象的现象却因金属离子的不同而不同;如与气体二氧化碳反应时,氢氧化钙能形成沉淀而氢氧化钠与二氧化碳因生成可溶性的碳酸钠而无明显现象;利用变化时现象的不同,可证明氢氧化钙的存在;
故答案为:
写在对话框中猜想:可能含有 NaOH 和 Ca(OH)2 (填化学式)
| 实验步骤 | 实验现象 |
| 通入足量的二氧化碳气体 | 试管中出现白色浑浊 |
点评:对反应后所得溶液的组成进行猜想时,首先可以确定反应后的生成物的存在,然后根据反应物的过量情况,对所得溶液进行猜想.

练习册系列答案
相关题目
在学习碳酸钠知识时,张老师在做完碳酸钠溶液和澄清石灰水反应演示实验后,对浑浊液过滤,得到澄清的滤液.对于滤液的组成,课堂上老师的提问和同学们的回答如下表:
| 人 员 | 对 话 |
| 老 师 | 问:滤液里可能含有哪些溶质呢? |
| 甲同学 | 答:可能是NaOH、Na2C03 |
| 乙同学 | 答:可能是NaOH、Na2C03、Ca(OH)2 |
| 丙同学 | 答:可能是NaOH |
| 丁同学 | 答:可能是______ |
| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中,______ | ______ | 自己的猜想成立 |
(3)甲同学针对自己的猜想进行了如下实验:
| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中,滴入足量稀盐酸 | 没有气体产生 | 甲的猜想不成立 |
(4)为了进一步证明甲同学的猜想,丁同学又进行了又下实验探究:
| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中,再滴入氯化钙溶液 | 生成______ | 甲的猜想成立 |
在学习碳酸钠知识时,张老师在做完碳酸钠溶液和澄清石灰水反应演示实验后,对浑浊液过滤,得到澄清的滤液.对于滤液的组成,课堂上老师的提问和同学们的回答如下表:
(1)假设你是丁同学,请你也提出一个与甲、乙、丙同学不同的猜想,把猜想写在上面表格中.并对你自己的猜想设计一个简单的实验加以证明.
(2)你认为甲、乙、丙同学的猜想都合理吗?如有不合理的请说明理由.______.
(3)甲同学针对自己的猜想进行了如下实验:
你认为甲同学的实验设计是否正确?请说明理由是______.
(4)为了进一步证明甲同学的猜想,丁同学又进行了又下实验探究:
写出碳酸钠溶液与氯化钙溶液反应的化学方程式______.
| 人 员 | 对 话 |
| 老 师 | 问:滤液里可能含有哪些溶质呢? |
| 甲同学 | 答:可能是NaOH、Na2C03 |
| 乙同学 | 答:可能是NaOH、Na2C03、Ca(OH)2 |
| 丙同学 | 答:可能是NaOH |
| 丁同学 | 答:可能是______ |
| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中,______ | ______ | 自己的猜想成立 |
(3)甲同学针对自己的猜想进行了如下实验:
| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中,滴入足量稀盐酸 | 没有气体产生 | 甲的猜想不成立 |
(4)为了进一步证明甲同学的猜想,丁同学又进行了又下实验探究:
| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中,再滴入氯化钙溶液 | 生成______ | 甲的猜想成立 |