��Ŀ����
(13��)2012��4��15�գ����ӡ�ÿ���������桱�������ҵ����ܡ��ع�ӱ�һЩ��ҵ��Ƥ����ϰ��Ƴ�����������һЩ��ҵ�Ƴ�ҩ�ý��ң���Щ���Ҳ��ֲ�Ʒ�������90���������������������£�
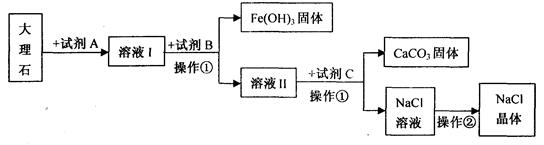
(1)������а����Ľ�Һ�Ƴɹ�ҵ�����Ĺ��̷���__________�仯��
(2)д����ʯ�ҽ����������ķ���ʽ________________________���÷�Ӧ��������Ϊ__________����Ӧ������_________����������ȡ����ȡ�����
(3)����Cr������������ɫ�н�������Ĺ��壬�нϸߵ��۵㣬����Ӳ�Ľ������������������ᷢ���û���Ӧ��������������и�Ԫ�ػ��ϼ�Ϊ+3�ۡ�
�ٸ���������Ϣ˵�������ʵ���������������������������������
��д���������ᷴӦ�Ļ�ѧ����ʽ__________________________��
����Ƥ���Ƴ�Ƥ�������Ҫ�����ظ���أ��ڼ��������·ֽ�ų���������Ӧ����ʽΪ��4K2Cr2O7===4K2CrO4+2Cr2O3+3X����X�Ļ�ѧʽ________��K2CrO4�и�Ԫ�صĻ��ϼ�Ϊ_______

(1)������а����Ľ�Һ�Ƴɹ�ҵ�����Ĺ��̷���__________�仯��
(2)д����ʯ�ҽ����������ķ���ʽ________________________���÷�Ӧ��������Ϊ__________����Ӧ������_________����������ȡ����ȡ�����
(3)����Cr������������ɫ�н�������Ĺ��壬�нϸߵ��۵㣬����Ӳ�Ľ������������������ᷢ���û���Ӧ��������������и�Ԫ�ػ��ϼ�Ϊ+3�ۡ�
�ٸ���������Ϣ˵�������ʵ���������������������������������
��д���������ᷴӦ�Ļ�ѧ����ʽ__________________________��
����Ƥ���Ƴ�Ƥ�������Ҫ�����ظ���أ��ڼ��������·ֽ�ų���������Ӧ����ʽΪ��4K2Cr2O7===4K2CrO4+2Cr2O3+3X����X�Ļ�ѧʽ________��K2CrO4�и�Ԫ�صĻ��ϼ�Ϊ_______
(1)������1�֣���
(2)CaO+H2O===Ca(OH)2(2��) ���Ϸ�Ӧ(1��) ����(1��)
(3)������ɫ�н���������壬�۵�ϸߣ�Ӳ�ȴ�2�֣�
��2Cr+3H2SO4===Cr2(SO4)3+3H2����2�֣�
��(��2��) O2 +6
(2)CaO+H2O===Ca(OH)2(2��) ���Ϸ�Ӧ(1��) ����(1��)
(3)������ɫ�н���������壬�۵�ϸߣ�Ӳ�ȴ�2�֣�
��2Cr+3H2SO4===Cr2(SO4)3+3H2����2�֣�
��(��2��) O2 +6
(1) ������а����Ľ�Һ�Ƴɹ�ҵ�����Ĺ���û���µ��������ɣ����������仯
(2)�����ƺ�ˮ�����������ƣ��ų�����
(3)���������غ㶨�ɵ�Ԫ���غ㣬��֪����Ӧǰ��Ԫ������䣬ԭ�Ӹ������䣬����Ʋ�X�Ļ�ѧʽΪO2�����ݻ��ϼ۵�ԭ���������������ϼ۵Ĵ�����Ϊ�㡱����K2CrO4�и�Ԫ�صĻ��ϼ�Ϊx����2����+1��+x+4����-2��=0����x=+6
(2)�����ƺ�ˮ�����������ƣ��ų�����
(3)���������غ㶨�ɵ�Ԫ���غ㣬��֪����Ӧǰ��Ԫ������䣬ԭ�Ӹ������䣬����Ʋ�X�Ļ�ѧʽΪO2�����ݻ��ϼ۵�ԭ���������������ϼ۵Ĵ�����Ϊ�㡱����K2CrO4�и�Ԫ�صĻ��ϼ�Ϊx����2����+1��+x+4����-2��=0����x=+6

��ϰ��ϵ�д�
�����Ŀ