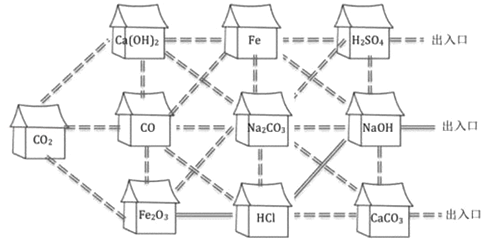
题目内容
【题目】为测定21.2g某变质氢氧化钠固体中碳酸钠的含量,将其配置成500mL溶液,分别取出50mL用两种方法进行测定,已知:Na2CO3+BaCl2═BaCO3↓+2NaCl
加入的试剂 | 测得数据 | |
方法1 | 足量BaCl2溶液 | BaCO3沉淀1.97g |
方法2 | 足量稀硫酸 | CO2气体0.44g |
请任选1种方法的数据,计算该固体中碳酸钠的质量分数(写出计算过程及结果)
【答案】解:设碳酸钠的质量为x
Na2CO3+BaCl2═BaCO3↓+2NaCl
106 197
x 1.97g![]()
x=1.06g,
该固体中碳酸钠的质量分数: ![]() =50%,
=50%,
答:该固体中碳酸钠的质量分数为50%.
【解析】根据碳酸钡的质量利用化学方程式计算出碳酸钠的质量,进而求质量分数.掌握根据化学方程式的计算步骤是解题的关键.
【考点精析】认真审题,首先需要了解根据化学反应方程式的计算(各物质间质量比=系数×相对分子质量之比).

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目