题目内容
【题目】天津是美丽的海滨城市,依山傍水,海洋资源和石灰石资源丰富。以下是我市对海水资源的部分利用。
(1)海水中含量最高的盐是 (填写化学式),海水经过 结晶可获得粗盐。
(2)粗盐中含有硫酸镁、氯化钙等可溶性杂质。再将粗盐溶于水,再进行如下操作:
①加过量的Na2CO3溶液;②加过量的Ba(OH)2溶液;③加适量的盐酸;④过滤;即可得到较纯净的氯化钠溶液,正确的操作顺序是 。
(3)从晒盐后的卤水中提取重要金属镁。提取镁的步骤如下:
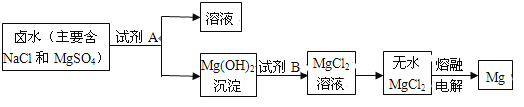
提取Mg的过程中,试剂A最好选用 (从我市有丰富的石灰石资源考虑填写物质名称),试剂B选用(填写名称)。
(4)“氨碱法”制纯碱是向饱和的氯化钠溶液中依次通入氨气、二氧化碳,析出碳酸氢钠晶体,同时生成另一种副产物可以做氮肥。再加热碳酸氢钠晶体可制得纯碱。写出上述反应的化学方程式:① ; ② 。
【答案】
(1)NaCl,蒸发
(2)②①④③
(3)氢氧化钙;稀盐酸;
(4)①NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl; ②2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
【解析】
试题分析:海水中含量最高的盐是NaCl,海水经过蒸发结晶可获得粗盐。粗盐中含有硫酸镁、氯化钙等可溶性杂质。再将粗盐溶于水,再进行如下操作:加过量的Ba(OH)2溶液;加过量的Na2CO3溶液;过滤;加适量的盐酸;即可得到较纯净的氯化钠溶液,过程中先加氢氧化钡目的是完全除掉硫酸镁,加入过量的碳酸钠目的是除掉过量的氢氧化钡,再加入盐酸将过量的碳酸钠反应变为氯化钠。提取Mg的过程中,试剂A最好选用氢氧化钙(从我市有丰富的石灰石资源考虑填写物质名称),试剂B选用盐酸,盐酸和氢氧化镁发生反应变为氯化镁, “氨碱法”制纯碱是向饱和的氯化钠溶液中依次通入氨气、二氧化碳,析出碳酸氢钠晶体,同时生成另一种副产物可以做氮肥。再加热碳酸氢钠晶体可制得纯碱,上述反应的化学方程式:①NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl; ②2NaHCO3![]() Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。


