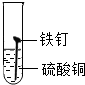
题目内容
(1)下列三种金属被发现、使用的先后顺序为:铜、铁、铝.金属大规模被使用的先后顺序跟(选填字母) 关系最大.
A.地壳中金属元素的含量 B.金属的导电性 C.金属的活动性
(2)目前世界上已有50%以上的废钢铁得到回收利用,其目的是(选填字母) .
A.节约金属资源 B.合理开采矿物 C.防止钢铁生锈
(3)生锈的铁制品放入盛有过量稀盐酸的洗槽中,观察到溶液变黄,有无色气泡逸出.写出其中之一的化学方程式 ,其反应类型是 .
(4)若要验证银、铁、锌的活动性顺序,某同学已经选择了打磨过的铁丝,你认为他还需要的另外两种溶液是 、 .
A.地壳中金属元素的含量 B.金属的导电性 C.金属的活动性
(2)目前世界上已有50%以上的废钢铁得到回收利用,其目的是(选填字母)
A.节约金属资源 B.合理开采矿物 C.防止钢铁生锈
(3)生锈的铁制品放入盛有过量稀盐酸的洗槽中,观察到溶液变黄,有无色气泡逸出.写出其中之一的化学方程式
(4)若要验证银、铁、锌的活动性顺序,某同学已经选择了打磨过的铁丝,你认为他还需要的另外两种溶液是
考点:金属活动性顺序及其应用,金属的化学性质,金属的回收利用及其重要性,反应类型的判定,书写化学方程式、文字表达式、电离方程式
专题:金属与金属材料
分析:(1)从人类大规模开发、利用金属的年限、先后顺序使用可以看出,金属的活动性越强,冶炼的程度越难,利用的越晚;
(2)根据金属的回收利用的目的解答,回收金属就是为了节约金属资源;
(3)铁锈的主要成分是氧化铁,能与稀盐酸反应,过量的盐酸还会和铁反应产生氢气,写出反应的方程式;
(4)根据金属与盐溶液反应的规律,结合“三取中”的常用验证金属活动性的方法分析.
(2)根据金属的回收利用的目的解答,回收金属就是为了节约金属资源;
(3)铁锈的主要成分是氧化铁,能与稀盐酸反应,过量的盐酸还会和铁反应产生氢气,写出反应的方程式;
(4)根据金属与盐溶液反应的规律,结合“三取中”的常用验证金属活动性的方法分析.
解答:解:(1)地壳里含量最高的金属是铝,但铝开发利用的时间比铜和铁晚,说明金属大规模开发、利用的先后顺序与地壳里金属含量无关,同时与金属的导电性也无关,而是与金属活动性顺序和金属冶炼的难易程度有关.故答案为:C;
(2)废钢铁得到回收利用,其目的是节约金属资源;故答案为:A;
(3)铁锈的主要成分是氧化铁,能与稀盐酸反应生成了氯化铁和水,过量的盐酸还会和铁反应产生氢气,反应分别为复分解反应和置换反应,故答案为:Fe2O3+6HCl=2FeCl3+3H2O(或Fe+2HCl=FeCl2+H2↑);复分解反应(或置换反应);
(4)可把打磨过的铁丝分别插入硫酸锌溶液、硝酸银溶液中,铁丝能置换出硝酸银中的银却不能置换硫酸锌中的锌,从而得到三种金属的活动性顺序为:锌>铁>银;故答案为:硫酸锌、硝酸银.
(2)废钢铁得到回收利用,其目的是节约金属资源;故答案为:A;
(3)铁锈的主要成分是氧化铁,能与稀盐酸反应生成了氯化铁和水,过量的盐酸还会和铁反应产生氢气,反应分别为复分解反应和置换反应,故答案为:Fe2O3+6HCl=2FeCl3+3H2O(或Fe+2HCl=FeCl2+H2↑);复分解反应(或置换反应);
(4)可把打磨过的铁丝分别插入硫酸锌溶液、硝酸银溶液中,铁丝能置换出硝酸银中的银却不能置换硫酸锌中的锌,从而得到三种金属的活动性顺序为:锌>铁>银;故答案为:硫酸锌、硝酸银.
点评:此题是一道综合性题目,考查了有关金属的活动性顺序、金属的合理利用及相关的性质,难度不大,需结合所学知识和题干信息仔细分析,从而作答.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
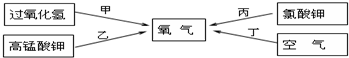
 如图是家用豆浆机,请根据图示回答下列问题:
如图是家用豆浆机,请根据图示回答下列问题: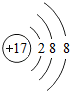 ,该粒子是
,该粒子是