题目内容
【题目】两个化学兴趣小组分别进行以下3个实验: ①MgSO4溶液和NaOH溶液反应
②稀H2SO4和BaCl2溶液反应
③稀HCl和NaOH溶液反应(用酚酞试液作指示剂)
实验结束后,同学们发现本组废液缸里废液颜色与另一小组不一样,在征得老师同意后,两组同学各自对本小组的废液进行探究: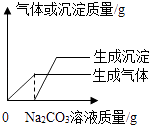
【提出问题】废液缸里的废液成分有什么?
【查阅资料】微溶物质在反应物中视作可溶物,在生成物中视为不溶物.
【实验探究】
(1)第1小组的探究: 小东首先把呈浑浊状态的废液进行分离,得红色澄清滤液和滤渣.
小刚认为无需进行实验,就能判断出滤渣中含有BaSO4、Mg(OH)2两种沉淀,他的理由是 , 请你写出生成其中一种沉淀的化学方程式: .
(2)小西对滤液成分(除酚酞、水外,下同)进行分析,认为滤液中一定含NaOH和NaCl,并对可能有的成分提出如下猜想: 猜想1:滤液中含有BaCl2
猜想2:滤液中含有Na2SO4
猜想3:滤液中含有BaCl2、Na2SO4
小强认为猜想3是不成立的,因为;
小雨取少量滤液于试管中,滴加溶液,出现的现象是 , 证明猜想2成立.
(3)第2小组的探究: 第2小组首先对废液进行了分离,得无色滤液和少量滤渣,然后取少量滤液于试管中,逐滴滴加Na2CO3溶液,并根据实验结果绘制成图如图所示.请据此判断,滤液一定含有的离子是(填离子符号),实验过程中滤液颜色的变化为 .
【交流反思】
实验结束后,同学们一致认为实验后的废液要进行处理才能排放,否则会对环境造成污染.
【答案】
(1)BaSO4不溶于水,也不溶于酸;滤液呈红色,说明NaOH溶液过量,Mg2+只能以沉淀氢氧化镁存在;2NaOH+MgSO4 =Na2SO4 +Mg(OH)2↓,或BaCl2+H2SO4=BaSO4↓+2HCl
(2)BaCl2、Na2SO4能相互发生化学反应,不能共存;BaCl2;产生白色沉淀
(3)H+、Mg2+、Na+、Cl﹣;无色变为红色
【解析】解:(1)2.小刚认为无需进行实验,就能判断出滤渣中含有BaSO4、Mg(OH)2两种沉淀,他的理由是:BaSO4不溶于水,也不溶于酸;滤液呈红色,说明NaOH溶液过量,Mg2+只能以沉淀氢氧化镁存在; 氢氧化钠和硫酸镁、氯化钡和硫酸反应的化学方程式分别为:2NaOH+MgSO4 =Na2SO4 +Mg(OH)2↓、BaCl2+H2SO4=BaSO4↓+2HCl.
故填:BaSO4不溶于水,也不溶于酸;滤液呈红色,说明NaOH溶液过量,Mg2+只能以沉淀氢氧化镁存在;2NaOH+MgSO4 =Na2SO4 +Mg(OH)2↓,或BaCl2+H2SO4=BaSO4↓+2HCl.(1)小强认为猜想3是不成立的,这是因为BaCl2、Na2SO4能相互发生化学反应,不能共存.故填:BaCl2、Na2SO4能相互发生化学反应,不能共存.(2)小雨取少量滤液于试管中,滴加BaCl2溶液,出现的现象是产生白色沉淀,证明猜想2成立.故填:BaCl2;产生白色沉淀.(3)由图中信息可知,滤液中的物质能和碳酸钠反应生成气体,说明滤液显酸性,溶液中存在氢离子;氢氧化钠和稀盐酸反应生成的氯化钠一定存在于滤液中,因此滤液中存在钠离子和氯离子;当显酸性的物质完全反应后,滤液中的物质能和碳酸钠反应生成沉淀,说明滤液中含有镁离子或钡离子,或同时含有镁离子和钡离子,但是因为滤液显酸性,所以镁离子不能形成沉淀,而在显酸性的溶液中钡离子能和硫酸根离子形成沉淀,所以滤液中一定含有镁离子,而钡离子是否存在无法确定;
当碳酸钠过量时,溶液显碱性,能使酚酞试液变红色,因此实验过程中滤液颜色的变化为无色变为红色.故填:H+、Mg2+、Na+、Cl﹣;无色变为红色.
【考点精析】掌握书写化学方程式、文字表达式、电离方程式是解答本题的根本,需要知道注意:a、配平 b、条件 c、箭号.