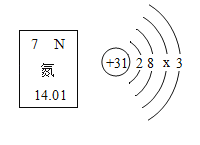
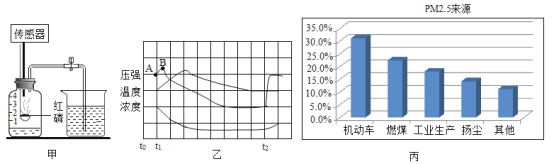
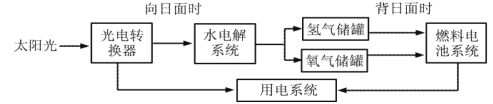
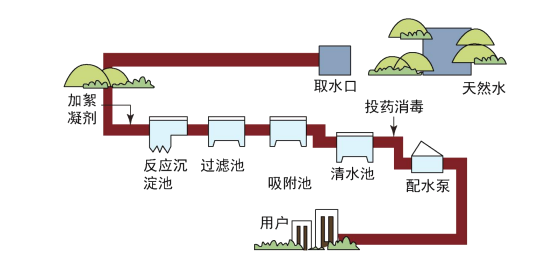
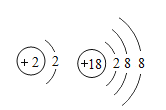题目内容
【题目】生铁用途十分广泛。工业上利用赤铁矿(主要成分是 Fe2O3,还含少量 SiO2 等杂质)冶炼生铁的过程如下:
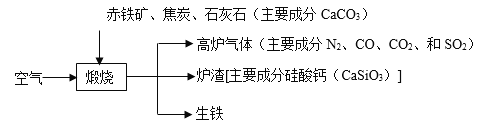
回答下列问题:
(1)生铁属于_____(填“合金”或“纯金属”),“高炉气体”中的_____(填化学式)会导致温室效应。
(2)用化学方程式表示利用CO炼铁的原理_____,CaCO3和SiO2 固体在高温条件下发生反应,生成CO2气体和CaSiO3,该反应的化学方程式为_____。
(3)生铁的出口低于炉渣的出口,原因是_____。
(4)生活中铁制品锈蚀的过程,实际上是Fe与空气中_____、_____等发生化学反应的过程。下列措施能防止铁制品锈蚀的是_____(填标号)。
A 涂油、喷漆 B 镀耐腐蚀的铬层
C 用盐水清洗 D 久置于酸性环境
【答案】合金 CO2 3CO+Fe2O3![]() 2Fe+3CO2 CaCO3+SiO2
2Fe+3CO2 CaCO3+SiO2![]() CaSiO3+CO2↑ 铁水的密度大于炉渣的密度 氧气 水 AB
CaSiO3+CO2↑ 铁水的密度大于炉渣的密度 氧气 水 AB
【解析】
(1)生铁是铁的合金,属于金属材料;二氧化碳CO2气体,会造成温室效应;
(2)CO炼铁的原理是一氧化碳还原氧化铁生成铁和二氧化碳,化学方程式为:3CO+Fe2O3![]() 2Fe+3CO2,CaCO3和SiO2 固体在高温条件下发生反应,生成CO2气体和CaSiO3,反应的化学方程式为:CaCO3+SiO2
2Fe+3CO2,CaCO3和SiO2 固体在高温条件下发生反应,生成CO2气体和CaSiO3,反应的化学方程式为:CaCO3+SiO2![]() CaSiO3+CO2↑;
CaSiO3+CO2↑;
(3)由于铁水的密度大于炉渣的密度,所以生铁出口低于炉渣出口;
(4)铁的锈蚀实质是Fe与空气中水、氧气等发生化学反应的过程;防止铁制品锈蚀就是将铁制品与水、氧气隔离,可用涂油、喷漆、镀耐腐蚀的铬层等方法防锈;用盐水清洗、久置于酸性环境会加速铁的锈蚀,故选AB。

【题目】我国约在南北朝时就开始冶炼黄铜。黄铜是铜和锌的合金(Cu-Zn) ,它可用来制造电器零件及日用品。为了测定某黄铜样品中铜的质量分数(不考虑黄铜中的其他杂质),兴趣小组同学设计了下列两个实验分别测定H2的质量和体积。
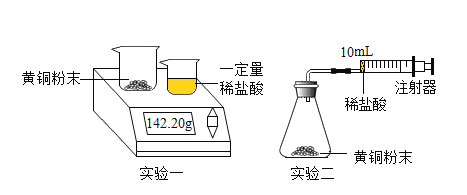
实验一:
称取10g黄铜样品粉末于大烧杯中,30g 稀盐酸于小烧杯中,将小烧杯中的稀盐酸分三次加入到大烧杯中,每次充分反应后,测定本次生成氢气的质量。
实验数据见下表。
第一次 | 第二次 | 第三次 | |
加入稀盐酸的质量(g) | 10 | 10 | 10 |
本次生成氢气的质量(g) | 0.04 | m | 0.02 |
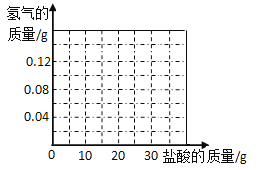
(1)m=_____,
(2)此黄铜样品中铜的质量分数是多少?_____,
(3)在坐标系中画出生成氢气总质量与加入盐酸的质量关系图像_____,
实验二:
(4)先连接好装置并检查装置气密性,然后装好一定量样品,最后将10mL稀盐酸快速推入锥形瓶中。若缓慢推入,则可能造成的后果是_____。
(5) 实验记录如下(表中数据在相同温度、相同压强条件下测定):
时间/min | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
注射器读数/mL | 70.0 | 95.0 | 98.0 | 99.0 | 99.5 | 99.8 | 99.9 | 100.0 | 100.0 | 100.0 |
根据以上实验过程和数据综合分析,最终生成H2的体积是_____mL。
【题目】教材“分解过氧化氢制氧气的反应中二氧化锰的催化作用”,以及“寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣。
(提出问题)氧化铁(化学式Fe2O3)能否作过氧化氢溶液分解的催化剂?如果能,其催化效果如何?
实验步骤 | 实验现象 |
①分别取5mL 5%过氧化氢溶液放入A、B两支试管中,向A试管加入a克氧化铁粉末,并分别在A、B两支试管中插入带火星的木条,观察现象。 | A试管中_____。 B试管中无明显现象 |
②待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管内,如此反复多次试验,观察现象。 | 试管内均产生大量气泡。带火星木条均复燃 |
③将实验②中的剩余物小心过滤,并将所得滤渣进行过滤、洗涤、干燥、称量。 | 所得固体质量为ag |
④分别取5mL5%过氧化氢溶液放入C、D两支试管中,向C试管中放入a克氧化铁粉末,向D试管中加入a克二氧化锰粉末。 | 现象略 |
(1)①中A试管的现象是_____;
(2)(实验结论)实验②、③证明:氧化铁的_____和_____在反应前后均没有发生变化,可以作过氧化氢分解的催化剂;
(3)写出氧化铁催化过氧化氢的化学反应表达式_____;
(4)(实验评论)实验设计④的目的是_____。
(5)(知识拓展)查阅资料得知,氧化铜、硫酸铜溶液、猪肝、马铃薯等也可以做过氧化氢溶液分解的催化剂,下列有关催化剂的说法正确的是_____;
A 同一个化学反应可以有多种催化剂
B 催化剂只加快反应速率
C MnO2 只能作为氧化氢溶液分解的催化剂