题目内容
【题目】下面是测量空气中氧气体积含量的实验:
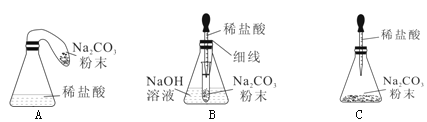
(1)实验小组按A装置进行实验后,发现进入集气瓶中水的体积超过总容积的1/5,你认为导致这一结果的原因可能是__________(填序号)。
A 实验前未将橡胶管夹紧
B 实验前导管中未加满水
C 红磷过量
D 氧气未消耗完
E 点燃的红磷伸入集气瓶速度过慢,使空气膨胀逸出
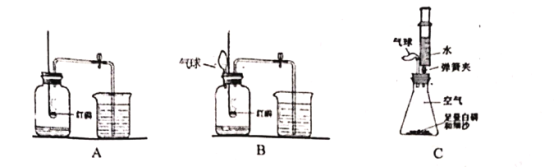
(2)因气体受热迅速膨胀,可能出现橡皮塞冲出等情况,实验小组将A进行了如B的改进,其所加气球的作用是__________
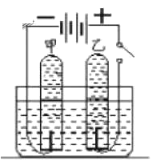
(3)实验小组又进行反思,B实验可以避免不安全因素,但是测得结果仍然不够准确。未形成真正的隔离体。该实验小组通过查阅资料,选定白磷(与红磷一样是一种磷的单质,燃烧产物也相同)在如图C所示装置中测量空气中氧气体积分数并取得成功。
[查阅资料]白磷着火燃烧的温度为40oC。
[提出问题]氧气体积约占空气总体积的多少?
[实验准备]锥形瓶内空气体积为230mL,注射器中水的体积为50mL,该装置气密性良好。
[实验探究]装入药品,按图所示连接好仪器,夹紧弹簧夹。先将锥形瓶底部放入热水中,自磷很快被引燃,然后将锥形瓶从热水中取出。
[现象分析]
①写出白磷在燃烧的化学方程式_________;
②待白磷熄灭、锥形瓶冷却到室温后,打开弹簧夹,还可观察到的现象是__________
【答案】AE 起缓冲作用 4P + 5O2![]() 2P2O5 注射器内有46mL水进入锥形瓶
2P2O5 注射器内有46mL水进入锥形瓶
【解析】
(1)A 实验前未将橡胶管夹紧,会氮气逸出,测得的结果偏大,符合题意;
B 实验前导管中未加满水,等装置冷却后,只能使流入瓶内的水减少,而不能使流入瓶内水的体积超过瓶内气体体积的1/5,不符合题意;
C 红磷过量,能完全消耗氧气,测得的结果不会偏小,不符合题意;
D 氧气未消耗完,测得的结果会偏小,不符合题意
E 点燃的红磷伸入集气瓶速度过慢,使空气膨胀逸出,测得的结果偏大,符合题意。故选AE;
(2)实验小组将A进行了如B的改进,其所加气球的作用是气球胀大,起缓冲作用,避免橡皮塞冲出;
(3)①白磷在空气中燃烧生成五氧化二磷,反应的化学方程式为:4P + 5O2![]() 2P2O5;
2P2O5;
②足量的白磷燃烧耗尽了装置内的氧气,冷却时室温后,装置内的压强减小,在外界大气压的作用下注射器内的水自动喷射出来。锥形瓶内空气体积为230mL,其中氧气的体积约为:![]() ,所以实验结束后,注射器内有46mL水进入锥形瓶;待白磷熄灭、锥形瓶冷却到室温后,打开弹簧夹,还可观察到的现象是注射器内有46mL水进入锥形瓶。
,所以实验结束后,注射器内有46mL水进入锥形瓶;待白磷熄灭、锥形瓶冷却到室温后,打开弹簧夹,还可观察到的现象是注射器内有46mL水进入锥形瓶。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
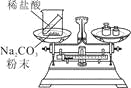
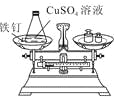
小学生10分钟应用题系列答案【题目】以下是老师引导学生探究“质量守恒定律”的教学片段,请你参与探究并帮忙填写空格(包括表中的空格)。
【提出问题】化学反应前后各物质的质量总和是否相等?
【猜想与假设】猜想1:不相等; 猜想2:相等。
【实验探究】甲、乙两组同学用托盘天平分别称量反应前后物质的质量。
甲 组 | 乙 组 | |
实验 |
|
|
实验 | 有气泡产生, | 铁钉表面有红色物质析出, |
结论 | 猜想1正确 | 猜想2正确 |
【反思评价】究竟哪种猜想正确?通过讨论,同学们发现甲组中有气体溢出,导致指针向右偏转。得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡是有气体生成或参加的反应一定要在 中进行。
【优化装置】同学们对甲组左盘中的反应装置进行了如下三种改进,你认为最佳装置是 (填序号),从另外两种装置中任选一种指出其不足 。
【得出结论】同学们利用改进后的最佳装置进行再次探究,均得出猜想二正确。进一步分析发现,反应体系中器材和未参加反应的物质的质量在反应前后保持不变,
最终得出结论是: 的各物质的质量总和等于反应后生成的各物质的质量总和。
【解释应用】解释:化学反应前后,原子的种类、数目、质量均不变,所以质量守恒。
应用:某固体物质受热会发生分解反应,生成氧化铜、水和二氧化碳三种物质,则该固体物质一定由 种元素组成。