题目内容
【题目】某品牌小包装“脱氧剂”成分为Fe粉、活性炭及少量NaCl.使用一段时间后,其中的Fe粉会转变成Fe2O3而变质.某科学兴趣小组欲探究使用前该“脱氧剂”中Fe粉的质量分数,设计并进行如下探究过程.注:溶液中的Fe元素最后已全部转化为Fe2O3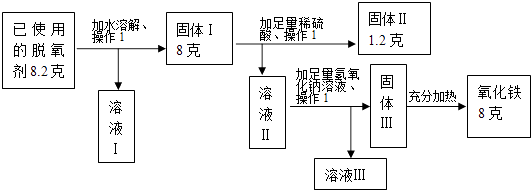
(1)探究过程中的操作1是;
(2)固体Ⅱ是(用化学式表示);
(3)使用前该“脱氧剂”中Fe的质量分数是多少?
【答案】
(1)过滤
(2)C
(3)解:由实验的过程可知,8.0g固体Ⅰ中Fe和Fe2O3两种物质的总质量为8.0g﹣1.2g=6.8g;
由质量守恒定律和实验的过程可知,氧化铁中铁元素的质量等于“脱氧剂”成分Fe粉的质量,所以
Fe粉的质量为:8.0g× ![]() ×100%=5.6g,
×100%=5.6g,
使用前该“脱氧剂”中Fe的质量分数是: ![]() =80%
=80%
答:使用前该“脱氧剂”中Fe的质量分数是80%.
【解析】解:(1)由题意可知,探究过程中的操作1是将固体和液体分开,操作是过滤;(2)由于活性炭不溶于水、稀硫酸,1.2g的固体是活性炭,化学式是:C, 答:(1)8过滤;(2)C;
【考点精析】根据题目的已知条件,利用金属材料的选择依据和根据化学反应方程式的计算的相关知识可以得到问题的答案,需要掌握黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属;各物质间质量比=系数×相对分子质量之比.

练习册系列答案
相关题目