题目内容
【题目】将7克含杂质的锌粒,加入到盛50 g稀硫酸的烧杯中,恰好完全反应(杂质不溶于水,也不参与反应),反应后称得烧杯内剩余物质的总质量为56.8g。
请计算:(1)产生氢气的质量_____;
(2)锌粒中锌的质量_____;
(3)稀硫酸中硫酸的质量分数_____;
(4)反应后的溶液中溶质的质量分数_____。
【答案】0.2g 6.5g 19.6% 28.6%
【解析】
解:(1)产生氢气的质量=7g+50g-56.8g=0.2g
故填:0.2g。
设生成0.2gH2需要Zn的质量为x,需要H2SO4的质量为y,生成ZnSO4的质量为z
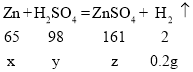
![]()
![]()
![]()
X=6.5g y=9.8g z=16.1g
(2)锌粒中锌的质量是6.5g;
故填:6.5g。
(3)根据溶液中![]() ,所用稀硫酸中硫酸的质量分数为
,所用稀硫酸中硫酸的质量分数为![]() ;
;
故填:19.6%。
(4)反应后的溶液中溶质的质量=16.1g,反应后的溶液的质量=6.5g+50g-0.2g=56.3g;
反应后的溶液中溶质的质量分数=![]() ;
;
故填:28.6%。

 名校课堂系列答案
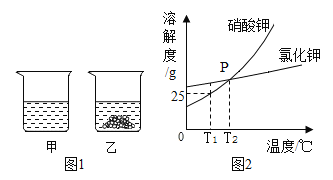
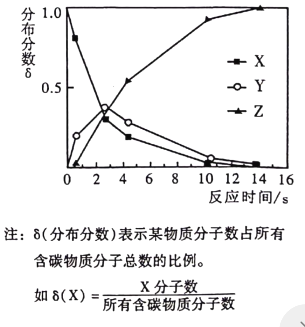
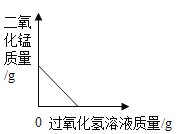
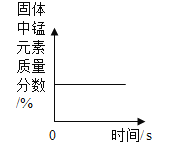
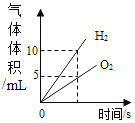
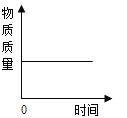
名校课堂系列答案【题目】下列图像能正确反映对应变化关系的是
|
|
|
|
A.向一定量的二氧化锰中加入过氧化氢溶液 | B.加热一 定量的高锰酸钾固体 | C.将水通电电解一段时间 | D. 镁带在耐高温的密闭容器(内含空气)内加热 |
A.AB.BC.CD.D
【题目】在学习“燃烧与灭火”的课堂上,老师做了一个有趣的实验:将一 根铜丝绕成线圈,罩在蜡烛火焰上(如图所示),观察到火焰立即熄灭。
(1)探究一:蜡烛熄灭的原因。
猜想与假设:a铜线圈隔离了可燃物;
b铜线圈隔绝了空气;
c铜线圈吸热,降温至蜡烛着火点以下。
讨论与交流:经观察分析同学们否定了猜想a和b,理由是___________________。
设计并进行如下实验:
实验操作 | 实验现象 | 结论 |
将铜圈加热后____________, | 蜡烛正常燃烧 | 猜想c正确 |
(2)探究二:经过多次上述实验大家发现铜丝表面变黑,黑色物质是什么呢?
猜想与假设:①炭黑;②氧化铜;③炭黑和氧化铜。
[查阅资料] :氧化铜可与稀硫酸反应生成硫酸铜(溶液显蓝色)和水,炭黑不与稀硫酸反应。
讨论交流:铜丝表面产生发炭黑或氧化铜的原因是_________________(写一条即可)。
实验操作 | 实验现象 | 结论 |
取少许黑色固体至试管中________________, | 固体部分溶解溶液变蓝色 | 猜想③正确 |