题目内容
将50克不纯的食盐(杂质不溶于水)放入360克水中,充分搅拌,待样品中的氯化钠全部溶解后过滤(假设操作过程中水分无损失),取滤液117克,向其中加入足量的硝酸银溶液,得到28.7克白色沉淀.试求:(1)所取的117克滤液中溶质的质量分数;
(2)食盐样品中氯化钠的质量分数.
【答案】分析:(1)根据硝酸银与氯化钠反应的化学方程式和生成沉淀的质量,列出比例式,就可计算出参与反应的NaCl的质量(即溶质质量);然后根据“溶质质量分数=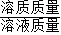 ×100%”计算即可;
×100%”计算即可;
(2)根据“溶剂质量÷溶剂含量”计算出滤液质量,再根据“滤液质量×10%”计算出食盐样品中氯化钠的质量,然后根据质量分数公式计算即可.
解答:解:(1)设参与反应的NaCl的质量为x,
AgNO3+NaCl═AgCl↓+NaNO3
58.5 143.5
x 28.7g
∴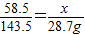
解之得:x=11.7g,
所取的117克滤液中溶质的质量分数为: ×100%=10%;
×100%=10%;
(2)滤液的总重量为:360g÷(1-10%)=400g,
食盐样品中氯化钠的质量为:400g×10%=40g,
食盐样品中氯化钠的质量分数为: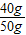 ×100%=80%.
×100%=80%.
答:(1)所取的117克滤液中溶质的质量分数为10%;
(2)食盐样品中氯化钠的质量分数为80%.
点评:本题主要考查学生运用化学方程式和溶质质量分数公式进行计算的能力.
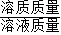 ×100%”计算即可;
×100%”计算即可;(2)根据“溶剂质量÷溶剂含量”计算出滤液质量,再根据“滤液质量×10%”计算出食盐样品中氯化钠的质量,然后根据质量分数公式计算即可.
解答:解:(1)设参与反应的NaCl的质量为x,
AgNO3+NaCl═AgCl↓+NaNO3
58.5 143.5
x 28.7g
∴
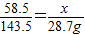
解之得:x=11.7g,
所取的117克滤液中溶质的质量分数为:
 ×100%=10%;
×100%=10%;(2)滤液的总重量为:360g÷(1-10%)=400g,
食盐样品中氯化钠的质量为:400g×10%=40g,
食盐样品中氯化钠的质量分数为:
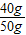 ×100%=80%.
×100%=80%.答:(1)所取的117克滤液中溶质的质量分数为10%;
(2)食盐样品中氯化钠的质量分数为80%.
点评:本题主要考查学生运用化学方程式和溶质质量分数公式进行计算的能力.

练习册系列答案
相关题目