题目内容
【题目】木炭还原氧化铜实验后的混合粉末中含有铜、氧化铜、木炭粉,某化学实验小组设计回收铜的方案如下: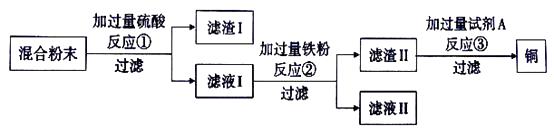
(1)过滤操作中必须用到的玻璃仪器有烧杯、漏斗和。
(2)反应①的化学方程式为。
(3)滤液Ⅰ中的溶质为。
(4)试剂A最好选用下列溶液(填序号)。
①H2SO4 ②CuSO4 ③MgSO4
(5)为了完善实验方案,可对滤渣Ⅰ中的进行回收。
【答案】
(1)玻璃棒
(2)H2SO4+CuO═CuSO4+H2O
(3)硫酸铜和硫酸
(4)①②
(5)Cu
【解析】(1)过滤操作中必须用到的玻璃仪器有烧杯、漏斗和玻璃棒(2)反应①是加入过量的稀硫酸,根据酸的化学性质,能与金属氧化物反应,故反应①的化学方程式为:H2SO4+CuO═CuSO4+H2O(3)由于反应①是加入过量的稀硫酸,故滤液Ⅰ中的溶质中除了生成的硫酸铜,还有过量的硫酸(4)由于反应②加入的是过量的铁粉,故滤渣II中是铁和铜的混合物,故就是除去铜中的杂质铁,应根据铁的化学性质:能与酸反应,能与盐溶液反应,故选①②(5)为了完善实验方案,可对滤渣Ⅰ中的Cu进行回收。
所以答案是:玻璃棒、H2SO4+CuO═CuSO4+H2O、硫酸铜和硫酸、①②、Cu。
【考点精析】通过灵活运用金属的回收利用及其重要性,掌握金属回收的意义:节约金属资源,减少环境污染即可以解答此题.

【题目】分类法是一种行之有效、简单易行的科学方法。某同学用下表所示形式对所学知识进行分类,其中甲与乙、丙、丁是包含关系。下列各组中,正确的组合是( )
选项 | 甲 | 乙、丙、丁 |
A | 常见可燃性气体 | 氢气、一氧化碳、氧气 |
B | 常见有机物 | 酒精、甲烷、二氧化碳 |
C | 常见营养物质 | 水、维生素、无机盐 |
D | 常见碱 | 烧碱、纯碱、熟石灰 |
A.AB.BC.CD.D
【题目】20℃时,取下表中的四种物质各 20g,分别加入到 100g 水中充分溶解后,有固体剩余的是
物质名称 | 氯酸钾 | 硝酸钾 | 氯化钠 | 蔗糖 |
溶解度(g/100g 水) | 7.4 | 31.6 | 36.0 | 203.9 |
A.氯酸钾B.硝酸钾C.氯化钠D.蔗糖
