题目内容
【题目】如图中的①、②是氟元素、钙元素在元素周期表中的信息,A、B、C、D是四种粒子的结构示意图.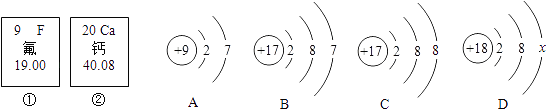
请你回答:
(1)氟元素在反应中易(填“得”或者“失”)电子,变成离子(用化学符号表示);D中X= .
(2)请从②中提取一条和数字有关的信息 .
(3)图中②与A元素组成的物质的化学式为;
(4)A,B,C,D属于同种元素的粒子是(填序号);
(5)A粒子的化学性质与B,C,D中哪一种粒子的化学性质相似(填序号).
【答案】
(1)得,F﹣,8
(2)钙元素的原子序数为20(其他合理答案也可)
(3)CaF2
(4)B C
(5)B
【解析】解:(1)最外层电子数大于4,易得电子,变成阴离子氟离子,18=2+8+x,所以x=8;(2)从②中提取一条和数字有关的信息有:钙的原子序数是20,相对原子质量是40.08;(3)钙显+2价,氟显﹣1价,所以化学式是:CaF2;(4)决定元素种类的是质子数,所以B、C属于同种元素;(5)决定元素化学性质的是最外层电子数,所以A和B化学性质相似.
所以答案是:(1)得;F﹣;8;(2)钙元素的原子序数为20(其他合理答案也可);(3)CaF2(4)B C (5)B

【题目】化学兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。同学们观察到镁条在空气中剧烈燃烧,发出耀眼的强光,产生的大量白烟弥漫到空气中,最后在石棉网上得到一些白色固体。
(1)请写出镁条燃烧的符号表达式______________________________;
(2)同学们通过称量发现:在石棉网上收集到产物的质量小于镁条的质量。有人认为这个反应不遵循质量守恒定律。你认为出现这样实验结果的原因可能是:_____________________;
(3)要使该反应能用于验证质量守恒定律,最合理的实验装置是____________(填序号);

(4)小红按右下图装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。

【提出问题】黄色固体是什么?
【查阅资料】(Ⅰ)镁能与二氧化碳反应生成碳和氧化镁;
(Ⅱ)镁能与氮气剧烈反应产生黄色的氮化镁(Mg3N2)固体;
(Ⅲ)氮化镁可与水反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
【做出猜想】
猜想一:固体是碳;
猜想二:固体是氧化镁
猜想三:黄色固体是Mg3N2
【实验探究】固体不可能是碳和氧化镁,原因①______________________;
请设计实验,验证猜想:
实验操作 | 实验现象 | 结论 | |
取少量固体于试管中,加水;将湿润的红色石蕊试纸放在试管口 | ②________________ | 该固体是Mg3N2 | |
【反思与交流】空气中N2的含量远大于O2的含量,可是镁条在空气中燃烧产物MgO却远多于Mg3N2,合理的解释是:③__________________________________。