题目内容
【题目】某同学在实验室完成稀硫酸与NaOH溶液进行中和反应的实验。

(1)写出该反应的化学方程式________
(2)由图甲推测,该同学是将______中,(从A “氢氧化钠溶液加入到稀硫酸”或B “稀硫酸加入到氢氧化钠溶液”选择,用序号填空),
(3)图甲中B点的含义是______, C点对应溶液中的溶质为_______。
(4)由图乙可知,该反应的微观实质是______结合成水分子。
【答案】H2SO4+2NaOH=Na2SO4+2H2O B 硫酸与氢氧化钠恰好完全反应 Na2SO4和H2SO4 H+与OH-
【解析】
(1)某同学在实验室完成的是稀硫酸与NaOH溶液进行中和反应的实验,所以反应的化学方程式为:H2SO4+2NaOH=Na2SO4+2H2O ,故填:H2SO4+2NaOH=Na2SO4+2H2O;
(2)由图甲知起点的溶液pH>7,所以溶液呈碱性,最终溶液的pH<7,所以溶液呈酸性,所以此实验是将稀硫酸加入氢氧化钠溶液中的,故填:B;
(3)图甲中B点的pH=7,说明此时溶液呈中性,说明酸与碱此时恰好完全反应,故填:硫酸与氢氧化钠恰好完全反应;
(4)由图乙可知,在此反应中,反应前的硫酸根离子和钠离子仍然存在,而反应前的氢离子和氢氧根离子没有了,在反应后多出了水分子,所以反应的实质是氢离子与氢氧根离子结合生成水分子的过程,故填:H+与OH-。

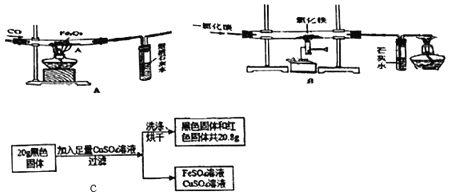
【题目】杨敏在实验室进行CO还原氧化铁的实验采用酒精灯加热(图A)与书本实验(图B)现象相同,发现在得到的黑色粉末中加稀盐酸,没有气泡产生,杨敏就图A实验中反应后得到的黑色粉末的成分进行了如下探究。
(查阅资料)①铁粉及铁的几种常见氧化物的颜色及部分性质。
物质 | 铁粉 | Fe2O3 | Fe3O4 | FeO |
颜色 | 黑色 | 红棕色 | 黑色 | 黑色 |
能否被磁铁吸引 | 能 | 不能 | 能 | 不能 |
②实验室酒精灯的温度为400﹣500℃,酒精喷灯的加热温度在1000℃左右。
③当温度高于300℃以上,Fe2O3容易被还原成Fe3O4;当温度高于600℃以上,Fe3O4容易被还原FeO;当温度高于700℃以上,FeO容易被还原成Fe;
(提出问题)图A实验得到黑色粉末的成分是什么?
(提出猜想)黑色粉末的成分是:①FeO、Fe3O4②FeO③Fe3O4;④FeO、Fe3O4、Fe2O3。
(分析与评价)猜想_____错误,理由是_____。
(1)装置A有一处明显错误,该错误是_____。
(2)请写出澄清石灰水中发生的反应的化学方程式_____。
(3)由对比实验可知,还原氧化铁的实验产物与_____有关。
(实验设计)将图A实验得到黑色粉末倒在一表面皿中,用磁铁接触黑色粉末,出现_____现象,说明猜想②正确。
(4)实验B最后得到的黑色固体可能是Fe和Fe3O4,中的一种或两种。小海设计如下实验探究其成分,请帮助他完成该探究过程。
(探究过程)①定性研究:取少量的图B实验得到的黑色粉末于一试管中,加入适量的硫酸铜溶液,充分振荡,出现_____现象,证明黑色固体中有铁。
②定量研究:取B实验得到的黑色固体20g,设计如图C实验:试推测黑色固体的成分是_____。
③有同学试图通过反应前后固体质量的变化来确定黑色固体的成分,你认为可行吗?(假设氧化铁在反应中完全反应)_____(填“行”或“不行”)理由是_____。