题目内容
(2009?南岗区一模)现有一瓶浓盐酸,标签如图所示,请根据标签上的数据回答问题:(1)取用8mL如右图所示标签的浓盐酸可以配制溶质质量分数为10%的稀盐酸的质量为______g;配制此稀盐酸所需要的仪器有胶头滴管、烧杯、玻璃棒和______(填仪器名称).
(2)利用刚配制的稀盐酸来测定某金属氧化物的化学式:取1.6g该金属氧化物(RO),向其中滴入刚配好的稀盐酸至恰好完全反应,共用去稀盐酸14.6g.
①写出发生反应的化学方程式______
②利用已知条件求解生成水质量(x)的比例式
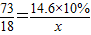
③金属氧化物的化学式是______
④若向反应后溶液中加入118.8g水后,此时所得溶液中溶质的质量分数为______.

【答案】分析:(1)先根据公式m=ρv计算出所给8ml盐酸的质量,再根据溶液稀释前后溶质质量不变的原则即可求解;
(2)①书写方程式时要注意R的化合价;
②③根据化学方程式的计算可得出答案;
④反应后的溶液为氯化铜溶液,溶质氯化铜的质量可根据化学方程式计算,溶液总质量为化学反应中生成的溶液质量+产生水的质量.
解答:解:(1)先根据公式m=ρv计算出所给8ml盐酸的质量=1.2g/cm3×8ml=9.6g
再根据溶液稀释前后溶质质量不变即:稀释前溶液质量×稀释前溶质质量分数=稀释后溶液质量×稀释后溶质质量分数,
设需10%的盐酸质量为y,
根据:稀释前溶液质量×稀释前溶质质量分数=稀释后溶液质量×稀释后溶质质量分数可知:9.6×36.5%=10%y
解得:y=35
稀盐酸配制过程中用到的实验仪器为:胶头滴管、烧杯、玻璃棒和量筒可知,答案为:量筒
故答案为:35 量筒
(2)①、书写方程式时根据R的化合价为+2,可得方程式为:RO+2HCl=H2O+RCl2
故答案为:RO+2HCl=H2O+RCl2
②、由①可知:化学方程式为:
RO+2HCl=H2O+RCl2
73 18
14.6×10% x
可得: =
=
故答案为: =
=
③、设R的相对原子质量为a,根据化学方程式:
RO+2HCl=H2O+RCl2
a+16 73
1.6 14.6×10%
可得: =
=
解得:a=64
可知R为铜
故选CuO
④、由③可知,R为铜,故化学方程式为:CuO+2HCl=H2O+CuCl2
设生成CuCl2为b
CuO+2HCl=H2O+CuCl2
73 135
14.6×10% b
可得:
∴b=2.7
根据质量守恒定律 生成氯化铜溶液的质量=氧化铜质量+盐酸质量=1.6+14.6=16.2
所以添加水后氯化铜溶液的总质量=16.2+118.8=135
所以氯化铜溶液中溶质质量分数= =
= ×100%=2%
×100%=2%
故答案为:2%
点评:本题考查有关化学方程式的简单计算.
(2)①书写方程式时要注意R的化合价;
②③根据化学方程式的计算可得出答案;
④反应后的溶液为氯化铜溶液,溶质氯化铜的质量可根据化学方程式计算,溶液总质量为化学反应中生成的溶液质量+产生水的质量.
解答:解:(1)先根据公式m=ρv计算出所给8ml盐酸的质量=1.2g/cm3×8ml=9.6g
再根据溶液稀释前后溶质质量不变即:稀释前溶液质量×稀释前溶质质量分数=稀释后溶液质量×稀释后溶质质量分数,
设需10%的盐酸质量为y,
根据:稀释前溶液质量×稀释前溶质质量分数=稀释后溶液质量×稀释后溶质质量分数可知:9.6×36.5%=10%y
解得:y=35
稀盐酸配制过程中用到的实验仪器为:胶头滴管、烧杯、玻璃棒和量筒可知,答案为:量筒
故答案为:35 量筒
(2)①、书写方程式时根据R的化合价为+2,可得方程式为:RO+2HCl=H2O+RCl2
故答案为:RO+2HCl=H2O+RCl2
②、由①可知:化学方程式为:
RO+2HCl=H2O+RCl2
73 18
14.6×10% x
可得:
 =
=
故答案为:
 =
=
③、设R的相对原子质量为a,根据化学方程式:
RO+2HCl=H2O+RCl2
a+16 73
1.6 14.6×10%
可得:
 =
=
解得:a=64
可知R为铜
故选CuO
④、由③可知,R为铜,故化学方程式为:CuO+2HCl=H2O+CuCl2
设生成CuCl2为b
CuO+2HCl=H2O+CuCl2
73 135
14.6×10% b
可得:

∴b=2.7
根据质量守恒定律 生成氯化铜溶液的质量=氧化铜质量+盐酸质量=1.6+14.6=16.2
所以添加水后氯化铜溶液的总质量=16.2+118.8=135
所以氯化铜溶液中溶质质量分数=
 =
= ×100%=2%
×100%=2%故答案为:2%
点评:本题考查有关化学方程式的简单计算.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案
相关题目


