题目内容
一定量的铜粉和镁粉的混合物与足量稀硫酸完全反应,过滤,所得固体不溶物在加热条件下与足量氧气充分反应后,所得产物的质量是原混合物质量的一半.则原混合物中铜粉和镁粉的质量比为( )A.2:3
B.3:2
C.1:1
D.4:3
【答案】分析:根据金属活动性镁>氢>铜,铜粉和镁粉的混合物与足量稀硫酸完全反应,镁粉全部反应过滤后所得固体为铜粉;铜粉在加热条件下与足量氧气充分反应生成氧化铜;因此,经过混合物与足量稀硫酸完全反应过滤后所得固体再在加热条件下与足量氧气充分反应后产物为氧化铜,所得产物氧化铜的质量是原混合物质量的一半,利用这一质量关系,根据铜与氧气反应的化学方程式,通过假设原混合物的质量,可解决原混合物中铜粉和镁粉的质量比.
解答:解:假设原混合物的质量为m,其中铜粉质量为x
2Cu+O2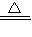 2CuO
2CuO
128 160
x
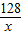 =
=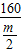
x=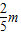
则原混合物中铜粉和镁粉的质量比=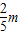 :(m-
:(m- )=2:3
)=2:3
故选A.
点评:本题主要涉及金属与酸及氧气反应的规律,利用金属活动性判断镁粉完全消耗及铜粉与氧气充分反应后得到氧化铜,为分析与解决问题的关键.
解答:解:假设原混合物的质量为m,其中铜粉质量为x
2Cu+O2
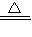 2CuO
2CuO128 160
x

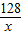 =
=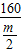
x=
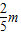
则原混合物中铜粉和镁粉的质量比=
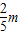 :(m-
:(m- )=2:3
)=2:3故选A.
点评:本题主要涉及金属与酸及氧气反应的规律,利用金属活动性判断镁粉完全消耗及铜粉与氧气充分反应后得到氧化铜,为分析与解决问题的关键.

练习册系列答案
 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目