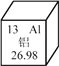
题目内容
【题目】下列能反映相关实验过程中量的变化的图象是( )
A.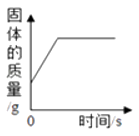 用一氧化碳还原氧化铁
用一氧化碳还原氧化铁
B.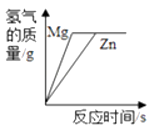 等质量镁、锌分别和足量的稀盐酸反应
等质量镁、锌分别和足量的稀盐酸反应
C. 向含少量Cu粉的铁粉中滴加稀盐酸至过量
向含少量Cu粉的铁粉中滴加稀盐酸至过量
D.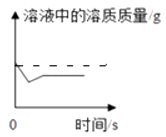 某温度时,向一定量的饱和氢氧化钙溶液中加入少量氧化钙,再恢复到原温度
某温度时,向一定量的饱和氢氧化钙溶液中加入少量氧化钙,再恢复到原温度
【答案】D
【解析】A.一氧化碳与氧化铁反应生成铁和二氧化碳,反应后氧化铁失去氧,则固体的质量应减少,A不符合题意;
B.镁的活动性比锌强,反应速率快,反应时间短;等质量镁、锌分别和足量等质量分数的盐酸反应,镁生成氢气的质量比锌多,B不符合题意;
C.向含少量Cu粉的铁粉中滴加稀盐酸时,立即产生氢气,最后气体的量为一定值,而图象中的起点不是零,C不符合题意;
D.因为开始生石灰与水反应生成氢氧化钙,所以溶剂质量减少,对于饱和氢氧化钙溶液来说,溶剂减少就会析出溶质,所以溶质减少,由于生石灰与水反应生成氢氧化钙时放出热量,在反应过程中温度升高,溶解度减小,但冷却后温度降低,溶解度又增大了,又溶解了一部分,温度不变后溶质也不变了,D符合题意;
所以答案是:D。
【考点精析】通过灵活运用金属活动性顺序及其应用和一氧化碳还原氧化铁,掌握在金属活动性顺序里:1、金属的位置越靠前,它的活动性就越强2、位于氢前面的金属能置换出盐酸、稀硫酸中的氢(不可用浓硫酸、硝酸)3、位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来.(除K、Ca、Na);原理:在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石里还原出来即可以解答此题.

【题目】下水道堵塞是日常生活中经常遇到的问题,“管道通”可使堵塞的管道畅通无阻。某同学对此很好奇,于是想探究“管道通”中物质的成分。请一起探究:
【提出问题】“管道通”中的物质是什么?
【查阅资料】
①下水管里的淤积物主要为油污、食物残渣、毛发等。
②氢氧化钠是强碱,能去除油污,腐蚀毛发一类的东西,常用于疏通管道。
③铝粉呈银灰色。
(1)铝与酸、强碱溶液都能反应放出氢气,同时放出大量热。
①铝与盐酸反应的化学方程式。
②铝与氢氧化钠溶液反应的化学方程式是2Al+2NaOH+═2NaAlO2+3H2↑
(2)【猜想与验证】打开一盒“管道通”,内有一袋白色固体颗粒和一袋银灰色粉末。
猜想:银灰色粉末为铝粉。
实验:取该粉末分别置于两支洁净的试管中,向一只试管中滴加稀盐酸,另一只中滴加溶液,都产生大量气泡且试管外壁温度明显升高,点燃反应产生的气体火焰呈淡蓝色。
结论:银灰色粉末为铝粉。
(3)猜想:白色固体颗粒为氢氧化钠。
实验操作 | 实验现象 |
①将几粒白色颗粒放在玻璃片上,放置一会儿。 | 白色颗粒潮解 |
②将几粒白色颗粒放入盛有少量水的试管中,并用手触摸试管外壁。 | |
③向步骤②得到的溶液中放入一段羊毛线,加热一段时间。 | 羊毛线逐渐消失 |
结论:白色固体颗粒为氢氧化钠。
(4)【应用】使用“管道通”时,先将银灰色粉状固体添加入被堵塞的管道中,再加入白色固体颗粒,倒入一杯水,堵上管道口。管道内可能出现的现象是。(填序号)
A.管道内温度明显升高
B.产生大量气体
C.管道被疏通
D.气体燃烧后,火焰成淡蓝色
(5)该“管道通”中的两种物质必须分开保存的原因 ,
该“管道通”必须密封保存的原因(用方程式表示)、。