题目内容
(8分)已知A—G均为初中化学常见的物质。其中A、B的组成元素相同,D是形成温室效应的主要原因,F中含有三种元素,E和G只有阳离子不同。根据图中所示的转化关系(图中“—”表示相互间能反应,“→”表示在一定条件下能生成该物质,反应条件均已略去),请回答:
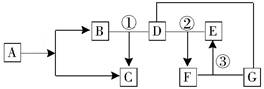
(1)C的化学式 、E中的阴离子符号是 、F的俗名为 ;
(2)反应①是自然界最常见的反应,我们称之为 ;反应②的化学方程式是 ;反应③的化学方程式是 ,该反应的基本类型是 反应,反应后过滤,把所得沉淀洗涤、干燥、称量,即可计算反应时消耗的F物质的质量。如果实验过程中没有洗涤,则计算所得F的质量 (填“偏大”或“偏小”或“不变”)。

(1)C的化学式 、E中的阴离子符号是 、F的俗名为 ;
(2)反应①是自然界最常见的反应,我们称之为 ;反应②的化学方程式是 ;反应③的化学方程式是 ,该反应的基本类型是 反应,反应后过滤,把所得沉淀洗涤、干燥、称量,即可计算反应时消耗的F物质的质量。如果实验过程中没有洗涤,则计算所得F的质量 (填“偏大”或“偏小”或“不变”)。
(1)O2 OH- 纯碱或苏打或面碱或碱面
(2) ①光合作用 ②CO2+2NaOH ==Na2CO3+H2O
③Ca(OH)2 + Na2CO3 =" =" CaCO3↓+ 2NaOH
【或Ba(OH)2 + Na2CO3 == BaCO3↓+ 2NaOH】 复分解 偏大
(2) ①光合作用 ②CO2+2NaOH ==Na2CO3+H2O
③Ca(OH)2 + Na2CO3 =" =" CaCO3↓+ 2NaOH
【或Ba(OH)2 + Na2CO3 == BaCO3↓+ 2NaOH】 复分解 偏大
试题分析: A、B的组成元素相同,且A→B+C;可知A为过氧化氢,B为水,C为氧气;D是形成温室效应的主要原因,即二氧化碳; E和G只有阳离子不同,且均能和二氧化碳反应,可知EG均为碱。F中含有三种元素,且可由D和E反应生成,则F应为碳酸盐。F可与G反应,则G为氢氧化钙或氢氧化钡,F为碳酸钠,E为氢氧化钠。
(1)C为氧气,其化学式为:O2;E为氢氧化钠,其中的阴离子为氢氧根,符号是OH-;F为碳酸钠,其俗名为纯碱或苏打或面碱或碱面;
(2)反应①是二氧化碳和水反应生成氧气,且是自然界最常见的反应,即光合作用;反应②是二氧化碳与氢氧化钠作用生成碳酸钠的反应,化学方程式是CO2+2NaOH ==Na2CO3+H2O;反应③是碳酸钠与氢氧化钙(或氢氧化钡)作用生成氢氧化钠的反应,化学方程式是Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH或Ba(OH)2 + Na2CO3 == BaCO3↓+ 2NaOH;该反应的基本类型是复分解反应。反应后过滤,把所得沉淀洗涤、干燥、称量,即可计算反应时消耗的F物质的质量。如果实验过程中没有洗涤,则称得的沉淀的质量偏大,然后计算所得F的质量会偏大。

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目