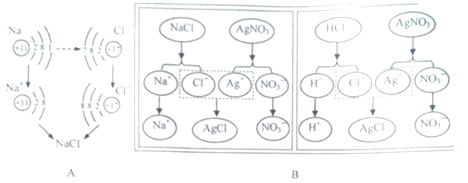
题目内容
【题目】水是生命之源,“爱惜水、保护水”是每个公民的义务和责任.
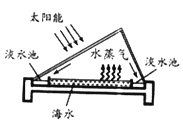
(1)海水淡化是获取淡水的方法之一,用如图方法获得淡水的过程中发生的是 变化(填写“物理”或“化学”);
(2)今年4月25日尼泊尔境内发生地震,高铁酸钾(K2FeO4)可用于灾区饮用水的净化,制备K2FeO4的化学反应方程式为:2Fe(OH)3+3Cl2+10KOH═2K2FeO4+6X+8H2O,X的化学式为 ,K2FeO4中Fe元素的化合价为 .
(3)污水处理是防止水污染的重要措施之一,某工厂甲、乙两车间产生的污水中各含有以下四种物质中的两种:Ba(NO3)2,KOH,K2SO4,HNO3,用石蕊试液和氯化钡溶液分别对两车间污水进行检测,现象如下表:

则甲车间产生的污水含有上述四种物质中的 ,工厂决定将两车间产生的污水排入反应池内充分反应后再排放,写出发生反应的中和反应的化学方程式 ,若反应池内各物质均恰好完全反应,排放液中的溶质是 (填写物质名称).
【答案】(1)物理;(2)KCl;+6(3)KOH、K2SO4;KOH+HNO3=KNO3+H2O;硝酸钾.
【解析】
试题分析:(1)海水淡化是将海水中的盐与水分离开,整个过程中并没有生成新的物质,发生的属于物理变化;
(2)由2Fe(OH)3+3Cl2+10KOH═2K2FeO4+6X+8H2O可知:
反应前 | 反应后 | |
Fe | 2 | 2 |
O | 16 | 16 |
H | 16 | 16 |
K | 10 | 4 |
Cl | 6 | 0 |
所以X的化学式为KCl;
在K2FeO4中,钾元素显+1价,氧元素显﹣2价,根据在化合物中正负化合价代数和为零,可得:(+1)×2+铁元素的化合价×1+(﹣2)×4=0,则铁元素的化合价=+6价。
(3)甲车间的污水中滴加石蕊试液变蓝色,证明甲中污水显碱性,其中含有KOH。因为KOH与HNO3不能共存,所以HNO3存在于乙中(同时符合乙车间的污水中滴加石蕊试液变红色的特点)。又因为甲中滴加氯化钡溶液出现白色沉淀,所以甲中还含有硫酸钾;则硝酸钡存在于乙污水中;
四种物质中的酸是硝酸,碱是氢氧化钾,二者发生中和反应生成硝酸钾和水;化学方程式为:KOH+HNO3=KNO3+H2O
若各物质恰好完全反应;则硝酸与氢氧化钾生成硝酸钾和水;硫酸钾与硝酸钡反应生成硫酸钡沉淀和硝酸钾.所以溶质为硝酸钾。