题目内容
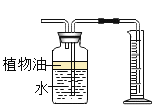
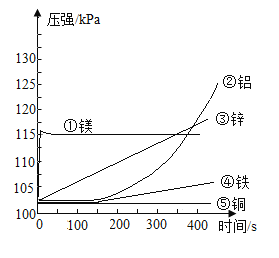
【题目】6.5g镁、铁、锌三种金属的混合物与200g稀硫酸恰好完全反应。生成0.4g氢气,反应后所得溶液中溶质的总质量是
A.6.1gB.16.1gC.206.lgD.25.7g
【答案】D
【解析】
由题意6.5g镁、铁、锌三种金属的混合物与200g稀硫酸恰好完全反应,生成硫酸镁、硫酸亚铁、硫酸锌和氢气,反应后所得溶液中溶质为硫酸镁、硫酸亚铁、硫酸锌,由质量守恒定律可知,根据元素守恒,反应后所得溶液中溶质的总质量为镁、铁、锌三种金属的总质量与硫酸根质量之和,已知生成氢气的质量为0.4g,则硫酸中氢元素的质量为0.4g,则硫酸的质量为![]() ,硫酸根的质量为
,硫酸根的质量为![]() ,则硫酸镁、硫酸亚铁、硫酸锌的总质量为6.5g+19.2g=25.7g,D选项正确,符合题意。故选D。
,则硫酸镁、硫酸亚铁、硫酸锌的总质量为6.5g+19.2g=25.7g,D选项正确,符合题意。故选D。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
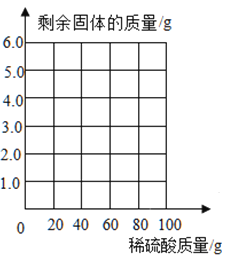
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】为了分析生铁中铁的含量,某学习小组进行了如下测定:称取6g生铁,然后将100g稀硫酸平均分五次加入,测得加入稀疏酸质量与放出氢气的质量如下表。(说明:生铁中的杂质不溶于水,也不与硫酸反应)
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
加入稀硫酸的质量/g | 20 | 20 | 20 | 20 | 20 |
产生氢气的累计质量/g | 0.05 | 0.10 | m | 0.20 | 0.20 |
(1)上表中m的值为__________。
(2)计算生铁中含铁的质量分数是_________?(写出计算过程,结果精确到0.1%)
(3)请根据数据和计算结果,在下图坐标中画出对应的曲线图______。
【题目】某班化学兴趣小组对催化剂的问题做了以下两类探究,请你一起参与他们的探究活动,并填空:
(1)甲同学探究“催化剂的种类对氯酸钾分解速率的影响”,设计了两组对比实验:
I将3.0g氯酸钾和0.5 g二氧化锰粉末均匀混合加热
II将3.0g氯酸钾和Xg氧化铜粉末均匀混合加热
①在相同条件下比较上述两组实验产生氧气的快慢,实验II中X的值应为___________。
②若氧化铜可以催化氯酸钾分解,写出反应的化学方程式____________。
(2)乙同学探究“红砖粉末是否也可以作为过氧化氢分解的催化剂”。
[提出问题]红砖粉末能不能做“过氧化氢分解”的催化剂呢?
[做出猜想]红砖粉末能做“过氧化氢分解”的催化剂。
[实验验证]
实验步骤 | 实验现象 | 实验结论 |
①将带火星的木条伸入装有过氧化氢溶液的试管中 | 木条不复燃 | 常温下过氧化氢分解速率很慢 |
②在上述试管中加入0.2g红砖粉末,然后将带火星的木条伸入试管中 | 木条复燃 | ①__________________, |
③待上述试管反应停止时,重新加入过氧化氢溶液,并把带火星的木条伸入试管 | 在化学反应前后,红砖粉末的②____________没有改变。 |
[实验讨论]
有同学认为:仅凭上述实验还不能证明红砖粉末能做过氧化氢分解的催化剂,还需要增加一个实验。 将实验后剩余固体提纯后称量,如果所得固体的质量等于0.2g,则说明红砖粉末可以作为过氧化氢分解的催化剂。
[实验拓展]查阅资料得知:硫酸铜、猪肝、土豆等也可以做过氧化氢溶液分解的催化剂。下列有关催化剂的说法中正确的是____________(填字母)。
A催化剂能增加生成物的量
B在工业生产中催化剂起到极大的作用
C催化剂只能加快化学反应的速率
D同一个化学反应可以有多种催化剂