题目内容
称取硝酸钠和硝酸银的固体混合物40g,放入烧杯中,加入188.7g氯化钠溶液恰好完全反应.待反应完全后过滤,称得滤液的质量为200g.计算:
(1)原固体混合物中的硝酸银的质量分数为多少?
(2)所得滤液中溶质的质量分数为多少?
解:(1)根据质量守恒定律,生成的氯化银沉淀的质量为:40g+188.7g-200g=28.7g,
设固体混合物中的硝酸银的质量为x,生成硝酸钠的质量为y,
AgNO3+NaCl═AgCl↓+NaNO3
170 143.5 85
x 28.7g y
 x=34g
x=34g
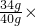 100%=85%.
100%=85%.
(2)恰好完全反应后所得滤液为硝酸钠溶液,
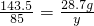 y=17g
y=17g
所得滤液中溶质的质量分数为 100%=11.5%.
100%=11.5%.
答:(1)原固体混合物中的硝酸银的质量分数为85%;
(2)所得滤液中溶质的质量分数为11.5%.
分析:(1)根据质量守恒定律可以计算出生成的氯化银沉淀的质量,进而根据反应的化学方程式可计算出原固体混合物中的硝酸银的质量及质量分数.
(2)由反应的化学方程式可知,恰好完全反应后所得滤液为硝酸钠溶液,根据反应的化学方程式可计算出生成硝酸钠的质量,据此结合溶质的质量分数的计算公式计算出反应后滤液的质量分数即可.
点评:本题难度不大,考查根据化学方程式的计算,根据质量守恒定律可以计算出生成的沉淀的质量是正确解答本题的关键.
设固体混合物中的硝酸银的质量为x,生成硝酸钠的质量为y,
AgNO3+NaCl═AgCl↓+NaNO3
170 143.5 85
x 28.7g y
 x=34g
x=34g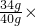 100%=85%.
100%=85%.(2)恰好完全反应后所得滤液为硝酸钠溶液,
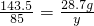 y=17g
y=17g所得滤液中溶质的质量分数为
 100%=11.5%.
100%=11.5%.答:(1)原固体混合物中的硝酸银的质量分数为85%;
(2)所得滤液中溶质的质量分数为11.5%.
分析:(1)根据质量守恒定律可以计算出生成的氯化银沉淀的质量,进而根据反应的化学方程式可计算出原固体混合物中的硝酸银的质量及质量分数.
(2)由反应的化学方程式可知,恰好完全反应后所得滤液为硝酸钠溶液,根据反应的化学方程式可计算出生成硝酸钠的质量,据此结合溶质的质量分数的计算公式计算出反应后滤液的质量分数即可.
点评:本题难度不大,考查根据化学方程式的计算,根据质量守恒定律可以计算出生成的沉淀的质量是正确解答本题的关键.

练习册系列答案
相关题目