题目内容
【题目】
第1次 | 第2次 | 第3次 | 第4次 | |
加入稀硫酸质量(g) | 100 | 100 | 100 | 100 |
剩余固体质量(g) | 87 | 74 | 67.5 | 67.5 |
(1)第2次测得剩余固体质量为74g,其成分为 .
A.铜
B.锌
C.铜和锌
(2)该黄铜样品中铜和锌的质量比m铜:m锌: .
(3)计算所用稀硫酸的溶质质量分数 , 并画出反应生成的氢气质量与加入稀硫酸质量的关系图 . 
【答案】
(1)C
(2)27:13
(3)19.6%,
【解析】(1)锌、铜两种金属中只有锌能与酸发生反应,第2次加入稀硫酸完全反应后剩余固体质量为74g,第3次加入稀硫酸固体质量还能减少说明第二次反应后剩余固体中仍有锌;;
(2)第四次加入酸固体质量不再减少说明锌已完全反应剩余固体全部是铜,故铜的质量为67.5g,所以该黄铜样品中铜和锌的质量比为:67.5g:(100g﹣67.5g)=27:13;所以答案是:27:13;
(3)第二次加入稀硫酸固体质量减少说明在第一次中固体锌过量,酸完全反应;可根据第一次物质的量进行计算;
设100g稀硫酸中溶质硫酸的质量为x,生成的氢气的质量为y;
Zn + H2SO4 ═ZnSO4 +H2↑
65 98 2
100g-67.5g x y
![]() =
=![]()
x=19.6g y=1g
所用稀硫酸的溶质质量分数为: ![]() ×100%=19.6%
×100%=19.6%
设完全反应的硫酸的质量是z
13g:100g=(100g-67.5g):z 解得z=250g.
由上计算可知,完全反应的硫酸的质量是250g,生成的氢气的质量是1g,可作出反应生成的氢气质量与加入稀硫酸质量的关系图如下: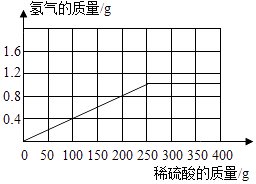
所以答案是:(1)C;(2)27:13;(3)19.6%;见解析.
【考点精析】根据题目的已知条件,利用根据化学反应方程式的计算的相关知识可以得到问题的答案,需要掌握各物质间质量比=系数×相对分子质量之比.