题目内容
【题目】(1)制备硅半导体材料必须先得到高纯硅,三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法.生产过程示意如下:
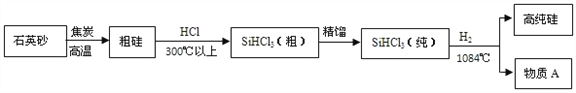
①整个制备过程必须达到无水无氧。在H2还原SiHCl3过程中若混入O2,可能引起的后果是_____________
②在生产过程中物质A可循环使用,A的化学式是____________。
(2) 钛和钛合金被认为是21世纪的重要金属材料,冶炼金属钛时,将铁铁矿石转化为下TiCl4,TiCl4再与Na在一定条件下反应生成Ti和NaCl。请写出后一步反应的化学方程式:__________________(不要求标反应条件),其反应类型是_________________。
【答案】 发生爆炸(生成的硅也会被氧化) HCl TiCl4+4Na===Ti+4NaCl 置换反应
【解析】①点燃或加热可燃性气体与空气的混合物可能发生爆炸。在H2还原SiHCl3过程中若混入O2,可能引起的后果是爆炸,同时硅在高温下易与氧气的反应而被氧化;②在上述生产流程中由粗硅到三氯甲硅烷和由三氯甲硅烷到高纯硅是两个相反的过程,在生产过程中物质A可循环使用,A的化学式是HCl;(2) TiCl4再与Na在一定条件下反应生成Ti和NaCl。反应的化学方程式:TiCl4+4Na===Ti+4NaCl,其反应类型是由一种单质和一种化合物生成另一种单质和另一种化合物的置换反应。

练习册系列答案
相关题目