题目内容
(2005?天津)将氯化镁和氯化钠的混合物25g溶于水后,加入密度为1.2/cm3、溶质的质量分数为20%的氢氧化钠溶液50mL,充分反应后,过滤;向滤液中加入73g溶质的质量分数为5%的盐酸,恰好完全反应.求原混合物中氯化镁的质量分数.
【答案】分析:向氯化镁和氯化钠的混合溶液中加入一定量的氢氧化钠溶液,氢氧化钠与氯化镁发生反应,充分反应后,过滤,向滤液中加入一定量的盐酸,恰好完全反应,说明滤液显碱性,原滤液中有剩余的氢氧化钠,所以说混合物中的氯化镁和73克5%的盐酸与50ml20%的氢氧化钠溶液恰好完全反应.根据73克5%的盐酸的质量求出滤液中氢氧化钠的质量,进而求出和氯化镁反应的氢氧化钠的质量,再根据和氯化镁反应的氢氧化钠的质量求出氯化镁的质量,最后根据 %求出混合物中氯化镁的质量分数.
%求出混合物中氯化镁的质量分数.
解答:解:50mL氢氧化钠溶液中NaOH的质量为:50mL×1.2g/cm3×20%=12g
盐酸中HCl的质量为:73g×5%=3.65g
设与盐酸反应的NaOH的质量为x,
NaOH+HCl=NaCl+H2O
40 36.5
x 3.65g
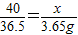
x=4g
与氯化镁反应的NaOH的质量为:12g-4g=8g
设与NaOH反应的氯化镁的质量为y
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
95 80
y 8g
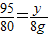
y=9.5g
氯化镁的质量分数为:
答:原混合物中氯化镁的质量分数为38%
点评:本道题对于学生来说比较难,是一道连环性的反应题,要解本道题必须要熟练掌握酸、碱、盐之间的反应规律.
 %求出混合物中氯化镁的质量分数.
%求出混合物中氯化镁的质量分数.解答:解:50mL氢氧化钠溶液中NaOH的质量为:50mL×1.2g/cm3×20%=12g
盐酸中HCl的质量为:73g×5%=3.65g
设与盐酸反应的NaOH的质量为x,
NaOH+HCl=NaCl+H2O
40 36.5
x 3.65g
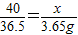
x=4g
与氯化镁反应的NaOH的质量为:12g-4g=8g
设与NaOH反应的氯化镁的质量为y
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
95 80
y 8g
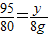
y=9.5g
氯化镁的质量分数为:

答:原混合物中氯化镁的质量分数为38%
点评:本道题对于学生来说比较难,是一道连环性的反应题,要解本道题必须要熟练掌握酸、碱、盐之间的反应规律.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
(2005?天津)今年我市科技周的主题是“珍惜资源,建设节约型社会”.随着经济的发展,人口的增长和人民生活水平的提高,水资源短缺的问题日益突出.
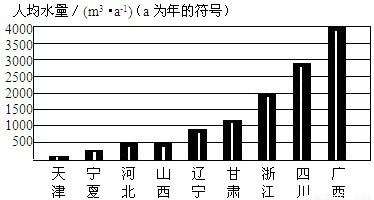
下列资料是我国部分地区人均水量图和水资源紧缺指标表.
资料一:我国部分省市人均水量图
资料二:水资源紧缺指标表
请回答:
(1)根据资料一和资料二的数据,分析我市的水资源紧缺程度为______.
(2)节约用水是每一位市民应遵守的公德,而在日常生活中,我们经常会看到一些浪费水的现象,例如水龙头滴水、跑水的问题.如果一个水龙头按每秒钟滴2滴水,平均每20滴水为1毫升来计算,一昼夜将流失水的体积为______升.(计算结果保留一位小数)

下列资料是我国部分地区人均水量图和水资源紧缺指标表.
资料一:我国部分省市人均水量图
资料二:水资源紧缺指标表
| 紧缺性 | 极度缺水 | 重度缺水 | 中度缺水 | 轻度缺水 |
| 人均水量/(m3.a-1) | <500 | 500~1000 | 1000~1700 | 1700~3000 |
(1)根据资料一和资料二的数据,分析我市的水资源紧缺程度为______.
(2)节约用水是每一位市民应遵守的公德,而在日常生活中,我们经常会看到一些浪费水的现象,例如水龙头滴水、跑水的问题.如果一个水龙头按每秒钟滴2滴水,平均每20滴水为1毫升来计算,一昼夜将流失水的体积为______升.(计算结果保留一位小数)