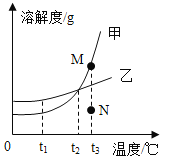
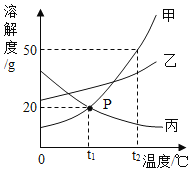
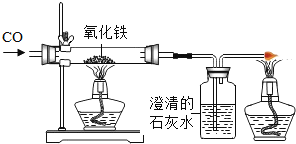
题目内容
【题目】一包固体粉末可能含有硝酸钠、碳酸钙、氢氧化钠、氯化铜、氯化钠和硝酸钙中的一种或几种。为确定其组成,某同学设计了如下实验方案。下列判断正确的是( )
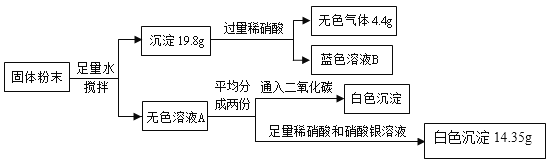
A.该混合物中一定含有碳酸钙、氢氧化钠、氯化铜、硝酸钙
B.蓝色溶液B呈中性
C.无色溶液A的溶质最多有3种
D.该混合物中一定不含氯化钠,可能含有硝酸钠
【答案】AD
【解析】
向19.8g沉淀中加入过量稀硝酸后,得到无色气体4.4g,
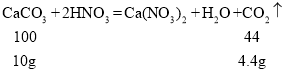 ,所以19.8g沉淀中碳酸钙的质量为10g,一定还有其它沉淀,而硝酸钠、碳酸钙、氢氧化钠、氯化铜、氯化钠和硝酸钙中能产生沉淀的除了碳酸钙外,只有氢氧化钠与氯化铜反应可以得到氢氧化铜沉淀,则氢氧化铜沉淀的质量为
,所以19.8g沉淀中碳酸钙的质量为10g,一定还有其它沉淀,而硝酸钠、碳酸钙、氢氧化钠、氯化铜、氯化钠和硝酸钙中能产生沉淀的除了碳酸钙外,只有氢氧化钠与氯化铜反应可以得到氢氧化铜沉淀,则氢氧化铜沉淀的质量为![]() 。
。
A. 固体粉末可能含有硝酸钠、碳酸钙、氢氧化钠、氯化铜、氯化钠和硝酸钙中的一种或几种,加入足量的水后,形成19.8g沉淀和无色溶液A,向沉淀中加入过量稀硝酸,碳酸钙与稀硝酸反应会产生无色气体二氧化碳,蓝色溶液B是由沉淀氢氧化铜与稀硝酸反应生成的硝酸铜表现出的蓝色,说明该混合物中一定含有碳酸钙、氢氧化钠、氯化铜;向无色溶液A中通入二氧化碳后产生白色沉淀,二氧化碳与其中的氢氧化钠反应生成碳酸钠,碳酸钠与硝酸钙反应可以生成碳酸钙白色沉淀,所以该混合物中一定含有硝酸钙。所以该混合物中一定含有碳酸钙、氢氧化钠、氯化铜、硝酸钙。故A符合题意;
B. 向19.8g沉淀中加入过量稀硝酸,形成蓝色溶液B中含有过量的稀硝酸,所以蓝色溶液B呈酸性。故B不符合题意;
C. 无色溶液A中通入二氧化碳后与过量的氢氧化钠反应生成碳酸钠,碳酸钠与硝酸钙反应产生白色沉淀碳酸钙,所以无色溶液A中一定含有氢氧化钠和硝酸钙;向无色溶液A中加入足量的稀硝酸和硝酸银,产生氯化银白色沉淀,所以无色溶液A中一定含有氯化钠(由氢氧化钠与氯化铜反应可以得到氯化钠或原混合物中含有氯化钠),无法检验是否含有硝酸钠(不与气体物质反应),所以无色溶液A中的溶质最多有氢氧化钠、硝酸钙、氯化钠和硝酸钠(可能含有)4种。故C不符合题意;
D. 由以上分析可得,19.8g沉淀中碳酸钙的质量为10g,氢氧化铜沉淀的质量为![]() ,根据
,根据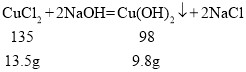 ,氯化铜中氯元素的质量为:
,氯化铜中氯元素的质量为:![]() ,将向无色溶液A分为等质量的两部分,其中一份加入足量的稀硝酸和硝酸银,产生氯化银白色沉淀14.35g,氯化银中氯元素的质量为:
,将向无色溶液A分为等质量的两部分,其中一份加入足量的稀硝酸和硝酸银,产生氯化银白色沉淀14.35g,氯化银中氯元素的质量为:![]() ,无色溶液A中含有的氯元素质量为3.55g×2=7.1g,即氯化银中的氯元素全部来自氯化铜,所以原混合物中一定不含氯化钠,但是硝酸钠不参与反应,无法检验原混合物中是否含硝酸钠,所以该混合物中一定不含有氯化钠,可能含有硝酸钠。故D符合题意。
,无色溶液A中含有的氯元素质量为3.55g×2=7.1g,即氯化银中的氯元素全部来自氯化铜,所以原混合物中一定不含氯化钠,但是硝酸钠不参与反应,无法检验原混合物中是否含硝酸钠,所以该混合物中一定不含有氯化钠,可能含有硝酸钠。故D符合题意。
故选AD。

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案【题目】现有三种常见治疗胃病药品的标签:
消化药片 每片含 碳酸钙 |
减缓胃痛 每片含 氢氧化镁 |
帮助消化 每片含 氧化镁 |
① | ② | ③ |
药品中所含的物质均能中和胃里过量的盐酸,下列关于三种药片中和胃酸的能力比较,正确的是( )
A.①![]() ②
②![]() ③B.①
③B.①![]() ②
②![]() ③C.③
③C.③![]() ②
②![]() ①D.②
①D.②![]() ③
③![]() ①
①
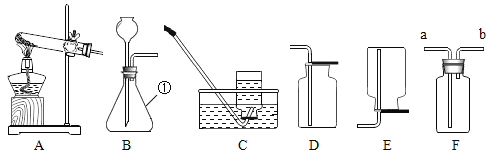
【题目】对比学习有利于发现事物的共性与个性。为探究酸的性质,同学们进行了如下实验。
实验内容 | 实验现象 | 分析与结论 |
| 醋酸晶体试管内___,醋酸溶液试管中镁带表面冒气泡。 | 酸的很多反应通常在水溶液中才能完成。 |
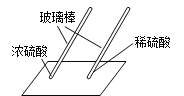
用玻璃棒蘸硫酸在白纸上写字 | _______(填“浓”或“稀”)硫酸使白纸炭化。 | 即使是同种酸,由于____不同,它们的性质不完全相同。 |
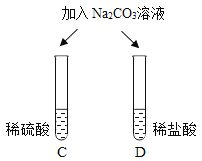
| 两试管中均产生_____ | 不同的酸具有相似的性质,这是因为酸的组成中都含有_____(填元素符号)。 |
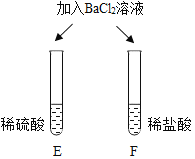
| E试管中产生_____, F试管中无明显现象。 | 不同的酸根会导致酸的“个性”差异。因此,可用氯化钡溶液鉴别盐酸和硫酸。 |
清洗试管时,小乔同学将C、F两试管中的无色液体同时倒入一个洁净的废液缸,废液缸中立刻冒气泡并出现白色沉淀。请分析上述现象并回答:
Ⅰ.废液缸中产生气体的化学方程式为______。
Ⅱ. 废液缸里最终产生的白色沉淀中一定有硫酸钡,可能有____(填化学式)。