题目内容
小林在凉拌紫卷心菜时,加入一些食醋,发现紫卷心菜变红了,这激发了他的探究欲望,特邀你协助完成下列活动与探究。
【提出问题】紫卷心菜等植物的汁液能作酸碱指示剂吗?
【实验探究】取紫卷心菜、牵牛花的花瓣、胡萝卜,分别在研钵中捣烂,加入酒精(乙醇与水的体积比为1∶1)浸泡,用纱布将浸泡出的汁液挤出,分别加入到蒸馏水、稀酸溶液和稀碱溶液中,有关颜色变化情况如下:
【得出结论】 、 的汁液能作酸碱指示剂, 的汁液不能作酸碱指示剂。
【拓展应用】小林用上述的牵牛花汁液来测定某雨水样品的酸碱性,发现牵牛花汁液呈红色。则该雨水呈 性(选填“酸”“碱”或“中”)。
【反思与评价】小林发现,上述汁液无法测出溶液的酸碱度,请你告诉他,在实验室测定溶液的酸碱度常用 。
【提出问题】紫卷心菜等植物的汁液能作酸碱指示剂吗?
【实验探究】取紫卷心菜、牵牛花的花瓣、胡萝卜,分别在研钵中捣烂,加入酒精(乙醇与水的体积比为1∶1)浸泡,用纱布将浸泡出的汁液挤出,分别加入到蒸馏水、稀酸溶液和稀碱溶液中,有关颜色变化情况如下:
| 汁液 | 在不同液体中的颜色变化 | ||
| 蒸馏水 | 稀酸溶液 | 稀碱溶液 | |
| 紫卷心菜 | 蓝紫色 | 红色 | 绿色 |
| 牵牛花 | 紫色 | 红色 | 蓝色 |
| 胡萝卜 | 橙色 | 橙色 | 橙色 |
【得出结论】 、 的汁液能作酸碱指示剂, 的汁液不能作酸碱指示剂。
【拓展应用】小林用上述的牵牛花汁液来测定某雨水样品的酸碱性,发现牵牛花汁液呈红色。则该雨水呈 性(选填“酸”“碱”或“中”)。
【反思与评价】小林发现,上述汁液无法测出溶液的酸碱度,请你告诉他,在实验室测定溶液的酸碱度常用 。
【得出结论】紫卷心菜 牵牛花 胡萝卜
【拓展应用】酸
【反思与评价】pH试纸或pH计
【拓展应用】酸
【反思与评价】pH试纸或pH计
能作酸碱指示剂的汁液应在酸碱性不同的溶液中显示不同的颜色,由题中实验结果可知,胡萝卜的汁液在中性、酸性和碱性三种环境中都显橙色,不能作酸碱指示剂;牵牛花的汁液在酸性环境中显红色,故该雨水样品显酸性;测定溶液的酸碱度最简单的方法是使用pH试纸,精确测量可使用pH计。

练习册系列答案
相关题目
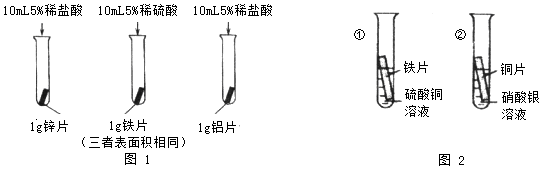
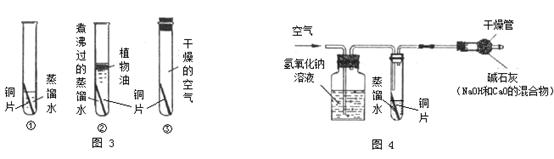
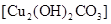 。他们依照钢铁生锈的探究方法设计如下实验(下图3所示)。请回答:
。他们依照钢铁生锈的探究方法设计如下实验(下图3所示)。请回答: