题目内容
据Science,Vol 303,Issue 5660,993-997,13February 2004报道:以铑的化合物为催化剂,乙醇与水的混合物部分氧化可有效地生产出氢气,同时得到另一副产物X,反应的化学方程式是C2H5OH+4H2O+O2=4X+10H2则X的化学式是______.乙醇的相对分子质量是______;乙醇分子中氢元素的质量分数是多少?______.
【答案】分析:根据质量守恒定律,化学反应前后原子的种类和数目不变可求出X的化学式;利用乙醇的化学式可计算出乙醇的相对分子质量;根据某元素的质量分数= ×100%可计算出乙醇分子中氢元素的质量分数.
×100%可计算出乙醇分子中氢元素的质量分数.
解答:解:根据化学反应前后,原子的种类、数目和质量都不变,根据此原则,不难推出该物质的化学式为CO2;乙醇的相对分子质量=12×2+1×5+16+1=46;乙醇分子中氢元素的质量分数是=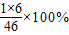 =13%.
=13%.
故答案为:CO2;46;13%或13.0%.
点评:在计算某元素的质量分数时,一定要把所求元素的原子个数写正确,不要漏掉.
 ×100%可计算出乙醇分子中氢元素的质量分数.
×100%可计算出乙醇分子中氢元素的质量分数.解答:解:根据化学反应前后,原子的种类、数目和质量都不变,根据此原则,不难推出该物质的化学式为CO2;乙醇的相对分子质量=12×2+1×5+16+1=46;乙醇分子中氢元素的质量分数是=
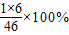 =13%.
=13%.故答案为:CO2;46;13%或13.0%.
点评:在计算某元素的质量分数时,一定要把所求元素的原子个数写正确,不要漏掉.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目