题目内容
【题目】小王同学在厨房中发现一袋白色粉末状的食用物,包装袋上表示的化学成分字迹不清,于是他带到实验室探究其成分。(填空没空1分,计算4分,计10分)
【猜想与假设】猜想1.可能是淀粉 猜想2.可能是纯碱
猜想3.可能是食盐 猜想4.可能是 (俗称小苏打)
【查阅资料】小苏打溶液显碱性,与氯化钡溶液不反应
【实验探究】
实验操作 | 实验现象 | 实验结论 |
(1)取样,溶于适量的水 | 形成无色溶液 | 猜想 不成立 |
(2)取少量品尝 | 有苦涩味 | 不是 |
(3)向(1)的溶液中滴加酚酞试液 | 溶液变红 | 是纯碱 |
小华认为,实验(3)结论不准确,原因是 。小华进一步进行了如下实验:取28g 所配溶液与50.2g氯化钡溶液混合,两种物质恰好完全反应。立即出现 ,由此他知道了该白色粉末是何物。过滤,所得滤液质量为58.5g,试计算:
(4)反应后生成的沉淀质量为 克.
(5)所得滤液中溶质的质量分数为多少?
【答案】 NaHCO3 ;;(1) 1;(2)食盐;(3)小苏打溶液显碱性也能使酚酞变红、白色沉淀;(3)19.7;(4)20%
【解析】
试题分析:根据物质的俗名可知猜想为碳酸氢钠,【实验探究】(1)取样,溶于适量的水形成无色溶液,猜想1不成立;(2)取少量品尝,有苦涩味,说明不是食盐;(3)向(1)的溶液中滴加酚酞试液,溶液变红,说明是纯碱的说法是不正确的叙述,因为小苏打溶液显碱性也能使酚酞变红,根据题中提供的资料,取28g 所配溶液与50.2g氯化钡溶液混合,两种物质恰好完全反应。立即出现白色沉淀,由此他知道了该白色粉末是碳酸钠,(4)根据质量守恒定律知,反应后生成沉淀的质量为:28g+50.2g-58.5g=19.7g;
(5)设反应生成氯化钠为X
Na2CO3+BaCl2==BaCO3↓+2NaCl
117
19.7g X
197:117=19.7g:X
X=11.7g
所得滤液中溶质的质量分数为:![]() =20%
=20%

【题目】鉴别碳酸钠溶液和氢氧化钠溶液的实验结束后,小红同学将①、②两支试管中的废液倒入同一个干净的烧杯中,看到烧杯内的废液变浑浊,过滤后,小红等几位同学对滤液的成分又进行了探究。
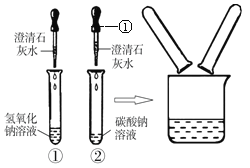
(1)指出有标号仪器的名称:_______。
(2)实验探究:
【猜想】 小红认为:只含氢氧化钠;
小明认为:
含有氢氧化钠、碳酸钠和氢氧化钙;
小亮认为:含有氢氧化钠和碳酸钠;
还有可能是 (你的猜想)。
【讨论】①三位同学的猜想,你认为是否有不合理,理由是 。 。
②小红的猜想是滤液中只含氢氧化钠,他的这种猜想的推测思路是:
。
【实验设计】设计一个简单的实验证明你的猜想正确。
实验步骤 | 实验现象 | 实验结论 |
取样于试管中, | 你的猜想正确 |
【实验分析】小亮同学针对自己的猜想进行了如下实验:
实验步骤 | 实验现象 | 实验结论 |
取样于试管中,滴入几滴稀盐酸 | 没有气泡产生 | 自己的猜想不成立 |
请你分析一下小亮同学验证自己的猜想所得出的实验结论是否正确: ,
原因是: 。