题目内容
【题目】甲、乙、丙是初中化学常见物质。这些物质之间的转化关系如下图所示。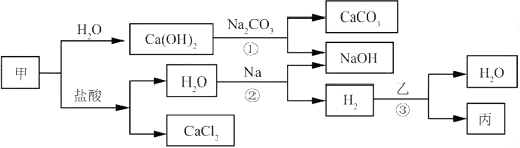
根据以上信息,请回答下列问题。
(1)写出甲的化学式。
(2)写出反应①的化学方程式。
(3)写出反应②的化学方程式。该反应属于反应(填基本反应类型)。
(4)反应③在一定温度下进行,若乙为Fe2O3 , 则丙为Fe;若丙为Cu,则乙为(填化学式)。
(5)请完成下列表格,证明Fe的金属活动性比Cu的强。
实验方案 | 实验现象 |
将铁片浸入(填化学式)溶液中 | 铁片表明析出固体 |
【答案】
(1)CaO
(2)Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
(3)2Na+2H2O=2NaOH+H2↑;置换
(4)CuO
(5)CuSO4(或CuCl2);红色
【解析】解:(1)甲既可以与水反应生成氢氧化钙,又可以与稀盐酸反应生成氯化钙和水,说明甲是氧化钙,化学式为CaO。
(2)反应①氢氧化钙和碳酸钠发生复分解反应,生成碳酸钙沉淀氢氧化钠,化学反应方程式为Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
(3)反应②钠与水的反应,生成氢氧化钠和氢气,根据质量守恒定律配平,则化学方程式为:2Na+2H2O=2NaOH+H2↑,单质钠与水反应生成单质氢气和化合物氢氧化钠,属于置换反应。
(4)反应③为氢气还原乙生成水和丙,若乙为氧化铁,则氢气还原氧化铁,生成铁和水;若丙为铜,则乙就为氧化铜,氢气还原氧化铜生成铜和水,因此,乙的化学式为CuO。
(5)要证明铁的金属活动性比铜强,就把铁单质放入铜的盐溶液中,看是否有铜置换出来,就可以比较铁与铜的金属活动性强弱。故应该浸入CuSO4(或CuCl2)溶液中,可以看到铁片表面有红色固体析出,即铜产生。
【考点精析】解答此题的关键在于理解书写化学方程式、文字表达式、电离方程式的相关知识,掌握注意:a、配平 b、条件 c、箭号.
