题目内容
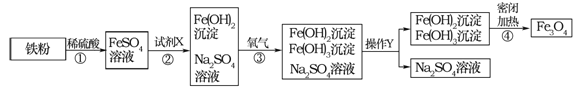
【题目】(7分)某兴趣小组在实验室发现一瓶敞口久置的氢氧化钠和一瓶未标浓度的稀盐酸。为测定氢氧化钠的变质情况和稀盐酸的浓度,他们取9.3g变质的氢氧化钠样品于锥形瓶中,加人50g水,充分溶解,再向锥形瓶中滴加未知浓度的稀盐酸。实验测得加入稀盐酸的质量与锥形瓶中物质的质量关系如下图所示。
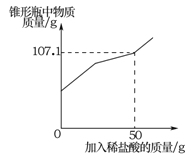
求:(1)9.3g样品中碳酸钠的质量。
(2)未知浓度的稀盐酸的溶质质量分数。
【答案】(1)含碳酸钠的质量为5.3g;(2)稀盐酸的质量分数为14.6%
【解析】
试题分析:因固体成分为氢氧化钠和碳酸钠。盐酸先与氢氧化钠反应生成氯化钠和水,此反应过程中不产生气体,为图像中的第一段。氢氧化钠反应完全后,盐酸与碳酸钠反应会生产氯化钠、水和二氧化碳气体。因有气体的产生,造成溶液质量增加幅度比上一个反应小。为图像中的第二段。当碳酸完全时,再加入盐酸,溶液中无反应发生。为图像中的第三段。根据图像可知:当加入稀盐酸的质量为50g时,与碳酸钠恰好完全反应。可根据溶液的总质量求出生成二氧化碳的质量
(1)根据题意可知:已知量为二氧化碳的质量,未知量为碳酸钠的质量。解题思路:可根据化学方程式中二氧化碳与碳酸钠的质量关系,求出碳酸钠的质量。
(2)在(1)中求出碳酸钠的质量,即可求出氢氧化钠的质量。再根据碳酸钠和氢氧化钠的质量分别求出与它们反应的纯盐酸的质量,即可求稀盐酸的质量分数。具体解题过程如下:
解:(1)生成二氧化碳的质量为:9.3g+50g+50g—107.1g=2.2g
设含碳酸钠的质量为x,与碳酸钠反应的纯盐酸的质量为y,与氢氧化钠反应的纯盐酸的质量为z;
Na2CO3+2HCl==2NaCl+H2O+CO2↑
106 73 44
x y 2.2g
106:44=x:2.2g
x=5.3g
73:44= y:2.2g
y=3.65g
HCl+NaOH==NaCl+H2O
36.5 40
z (9.3g—5.3g)
36.5:40=z: (9.3g—5.3g)
z=3.65g
稀盐酸的质量分数为:![]() ×100%=14.6%
×100%=14.6%
答:(1)含碳酸钠的质量为5.3g;
(2)稀盐酸的质量分数为14.6%

【题目】关于下列事实的解释不正确的是
选项 | 事实 | 解释 |
A | 10mL酒精和10mL水混合后体积小于20mL | 分子之间有间隔 |
B | 稀硫酸和稀盐酸化学性质相似也存在差异 | 溶液中都含有H+,也存在不同的SO42—、Cl—离子 |
C |
| 化学反应中每个原子都易得1个电子 |
D | 化肥硫酸铵不能和熟石灰混放或混用 | 硫酸铵与熟石灰发生中和反应 |
【题目】家庭生活中一些常见物质的pH如下:
物质 | 食醋 | 牛奶 | 食盐水 | 牙膏 | 肥皂水 |
pH | 2~3 | 6~7 | 7 | 8~9 | 9~10 |
当我们被蚊虫叮咬后,蚊虫能在人的皮肤内分泌蚁酸(具有酸的性质),从而使皮肤肿痛。要减轻痛痒,应在叮咬处涂抹下列物质中的 ( )
A.食醋 B.牛奶 C.食盐水 D.牙膏或肥皂水