题目内容
【题目】2017年“世界水日”我国的宣传主题是:“落实绿色发展理念,全面推行河长制”。水是生命之源,我们每个人都要关心水、爱护水、节约水。
(1)我国生活饮用水的水质必须达到下列四项指标:
a.不得呈现异色 b.不得有异味 c.应澄清透明 d.不得含有细菌和病毒
a指标和b指标可通过加入________(填物质名称),利用其________作用来完成,c指标可通过________操作达到,d指标可通过加入消毒剂实现。二氧化氯(ClO2)是一种高效的消毒剂,可通过下列反应来制取,Cl2+2NaClO2==2ClO2+2X, X的化学式为________,该反应中氯元素没有呈现的化合价是________。
① -1 ② 0 ③+1 ④+3 ⑤+4 ⑥+7
(2)生活中可以采用________区分硬水和软水,可以通过________的方法降低水的硬度。
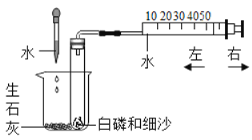
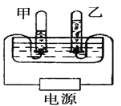
(3)如图是电解水的实验装置,水中常加入少量的硫酸钠或氢氧化钠,目的是____________,甲试管与电源的________(填“正”或“负”)极相连,甲、乙两试管内产生气体的质量比为________,该实验说明水是由_____________组成。
(4)节约用水,从我做起。请写出你的家庭中节约用水的措施之一__________________。
【答案】活性炭 吸附 过滤 NaCl ③⑥ 肥皂水 煮沸 增强水的导电性 负 1︰8 氢元素和氧元素 淘米水洗菜(浇花)或洗衣服的水拖地(冲马桶)等(合理答案均可)
【解析】
(1)根据水的净化方法,质量守恒定律,化合物中各元素化合价为零进行分析解答;
(2)根据硬水和软水区别方法和转化方法进行分析解答;
(3)根据水的电解实验进行分析解答;
(4)根据节约用水的方法解答。
(1)活性炭具有吸附性,能除去水中的色素和异味,所以a指标和b指标可通过加入活性炭,利用其吸附作用来完成;过滤可除去水中的不溶物,可以通过过滤操作使水达到澄清透明的程度,所以c指标可通过过滤操作达到;由化学反应前后原子的种类和数目不变,根据Cl2+2NaClO2==2ClO2+2X可知,反应物的微粒中有2个钠原子、4个氯原子、4个氧原子,在生成物的微粒中有4个氧原子、2个氯原子,还少2个氯原子和2个钠原子,所以X化学式是NaCl;该反应中氯气中氯元素显0价,NaClO2中的氯元素显+3价,ClO2中的氯元素显+4价,NaC中的氯元素显-1价,氯元素没有呈现的化合价是+1价和+7价,故选③⑥;
(2)在水样中加入肥皂水搅拌,产生泡沫较少的是硬水,产生泡沫较多的是软水,所以用肥皂水鉴别硬水和软水;水样煮沸,可使水中的钙、镁离子形成沉淀,降低水的硬度,所以可以通过煮沸的方法降低水的硬度;
(3)水中常加入少量的硫酸钠或氢氧化钠,目的是增强水的导电性,水通电分解,正极生成氧气,负极生成氢气,二者的体积比1:2,甲中气体体积较多,甲试管与电源的负极相连,水电解的反应方程式是:2H2O ![]() 2H2↑+ O2 ↑,可知氧气与氢气的质量比=4:32 =1:8,甲、乙两试管内产生气体的质量比为1:8,电解水生成了氢气和氧气,氢气是由氢元素组成,氧气是由氧元素组成,化学变化中元素的种类不变,此实验可以说明水是由氢元素、氧元素组成的;
2H2↑+ O2 ↑,可知氧气与氢气的质量比=4:32 =1:8,甲、乙两试管内产生气体的质量比为1:8,电解水生成了氢气和氧气,氢气是由氢元素组成,氧气是由氧元素组成,化学变化中元素的种类不变,此实验可以说明水是由氢元素、氧元素组成的;
(4)家庭中节约用水的措施有淘米水洗菜(浇花)或洗衣服的水拖地(冲马桶)等(合理答案均可)。

 阅读快车系列答案
阅读快车系列答案【题目】某小组将光亮铜片放在酒精灯火焰上加热,发现表面变黑,他们对黑色物质来源展开探究。
(猜想假设)猜想1:黑色固体是酒精燃烧生成。
猜想2:黑色固体是铜与空气反应生成。
(查阅资料)
(1)酒精等含碳物质在氧气不充足时会燃烧生成炭黑,炭黑难溶于水,与稀硫酸不反应。
(2)氧化铜加热时能溶于稀硫酸生成蓝色溶液
(进行实验)
实验步骤和方法 | 实验现象 | 实验结论 |
实验一:取一小段光亮铜片,放入试管内,然后用试管夹夹持试管,放在酒精灯的外焰部位加热。 | 铜片表面_______(“变”或“不变”)黑。 | 猜想1不正确 |
实验二:另取一小段光亮铜片用金属铝严密包裹,压紧不留空隙,放在酒精灯的外焰部位加热一段时间后,打开包裹的铝箔,观察现象。 | 刚打开包裹的铝箔时铜片不变黑;一段时间后铜片变黑。 | 猜想2正确 |
实验三:再取一小段光亮铜片,在酒精灯火焰上加热变黑。然后把附着黑色固体的铜片投入到有稀硫酸的试管中,加热。 | 盛黑色固体全部溶解消失,溶液____。 | 猜想2正确 |
(反思拓展)
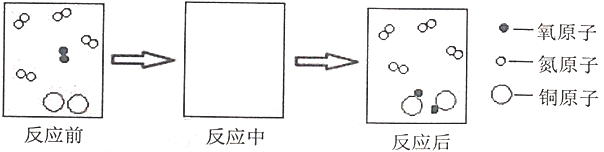
(1)请用符号表达式表示黑色物质的来源:_______;反应过程的微观示意图可简单表示如下,请在反应中方框内画出正确的图示。_______
(2)实验二用金属铝箔将铜片严密包裏的目的是_______;
(3)实验方案的设计主要有从反应物和从生成物两个角度。上述实验主要从反应物角度设计的是______(填序号)
a.实验一 b.实验二 c.实验三
【题目】某校研究性学习小组在做“寻找新的催化剂”课题时,发现将生锈的铁钉放到过氧化氢溶液中,也可以加快过氧化氢的分解速率。于是,他们对此展开探究:
(提出问题)生锈的铁钉中,哪种物质能做H2O2分解的催化剂?与二氧化锰相比哪种物质更适合H2O2做分解的催化剂?
(提出猜想)猜想一:林菲同学:铁钉表面的氧化铁是过氧化氢溶液分解反应的催化剂。
猜想二:小华同学:铁钉中的铁是H202分解的催化剂。
实验编号 | 操作步骤 | 实验现象 |
实验1 | 将带火星的木条伸入盛有10mL 5%的H2O2溶液的试管内,观察现象 | 木条不复燃 |
实验2 | 在盛有1克氧化铁固体的试管中加入10mL5%的H2O2溶液,再将带火星的木条伸入试管内,观察现象. | 有大量气泡产生,带火星的木条复燃 |
实验3 | 在盛有1克铁粉的试管中加入10mL 5%的H2O2溶液,再将带火星的木条伸入试管内,观察现象. | 木条不复燃 |
(分析与结论)
(1)设计“实验1”的作用是_________;
(2)由上述实验可知,猜想___错误。实验(2)反应的文字表达式为______;
(3)同学们讨论后认为,林菲同学的“实验2”还不能够确切的证明氧化铁就是过氧化氢分解制取氧气的催化剂,理由是:___________。
(4)小华通过仔细观察发现“实验3”中一直没有变化的试管,过了一段时间后试管中也出现了气体,小华觉得很奇怪,你能猜想其中的原因吗?______
(5)请设计实验探究氧化铁和二氧化锰,哪种物质更适合做H2O2分解的催化剂?___________。