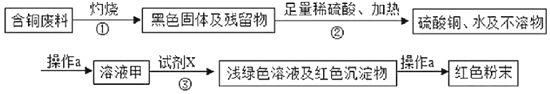
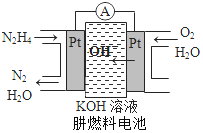
��Ŀ����
����Ŀ��ʵ������һƿδ֪Ũ�ȵ�BaCl2��Һ��ijͬѧȡ��150g����Һ���ձ��У���������μ���������������Ϊ26.5%��Na2CO3��Һ����Ӧ���������ɳ���������������Na2CO3��Һ�����Ĺ�ϵ��ͼ��ʾ����֪��BaCl2��Na2CO3=BaCO3����2NaCl������㣺
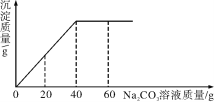
(1)����26.5%��Na2CO3��Һ80g����ҪNa2CO3����___g��
(2)BaCl2��Һ����������������____��(д��������̣����������0.1%)
���𰸡�(1) 21.2g����2��13.9%
��������
���⣨1�� ��������������������ı���ʽ������26��5%��Na2CO3��Һ80g����ҪNa2CO3��������=80g��26��5%=21��2g
��2����ͼ���л�֪����BaCl2��ȫת��Ϊ����ʱ����Na2CO3��Һ������Ϊ40g,�ٸ��ݻ�ѧ��Ӧ����ʽ��BaCl2��Na2CO3��BaCO3����2NaCl��Na2CO3��BaCl2��������ϵ�������BaCl2�����������������BaCl2��Һ��������������
�⣺��BaCl2������Ϊx
BaCl2��Na2CO3��BaCO3����2NaCl
208����106
x����40g��26��5%
208��106��X��(40g��26��5%)
x��208��40g��26��5%/106��20��8g
��BaCl2��Һ������������������20��8g/150g����100%=13��9%
�𣺸�BaCl2��Һ��������������Ϊ13��9%

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�