题目内容
【题目】化学兴趣小组在李老师指导下,改进了“测量空气中氧气体积分数”的实验装置(见下图),并进行以下实验探究活动,请你一同参与。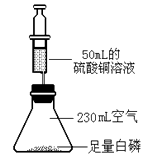
【查阅资料】
①白磷剧毒,着火点低(40℃),易燃烧,且耗氧彻底。
②硫酸铜溶液能与白磷反应,从而化解白磷的毒性。
(1)【实验探究】
①在确保装置不漏气时,按图装入药品、连好仪器。
②将锥形瓶底部放入热水中,白磷很快被引燃。白磷燃烧的化学方程式是。
③燃烧结束后,等到锥形瓶冷却到室温,按下注射器,使注射器针头穿透橡皮塞,此时注射器里的硫酸铜溶液会 , 以弥补氧气的体积。如果实验比较成功,测得氧气的体积分数约是 , 最终注射器里的液面约停留在mL刻度处。
(2)【反思评价】
①实验结束、振荡锥形瓶,硫酸铜溶液能与剩余的白磷发生反应,有关的化学方程式为:
11Px +60CuSO4 +96H2O = 20Cu3P↓+24H3PO4 +60H2SO4 , 则x=。
②此改进装置与课本上“测量空气中氧气体积分数”实验装置相比,有不少的优点,请你写出1条:。
【答案】
(1)4P+5O2 ![]() 2P2O5,自动喷入锥形瓶内,1/5(或21%),4(或1.7)
2P2O5,自动喷入锥形瓶内,1/5(或21%),4(或1.7)
(2)4,无污染、误差小、操作简便等
【解析】【实验探究】②白磷燃烧生成五氧化二磷,反应的化学方程式表示为4P+5O2 ![]() 2P2O5 ;③白磷燃烧消耗氧气导致瓶内的压强减小,按下注射器,使注射器针头穿透橡皮塞,此时注射器里的硫酸铜溶液会自动喷入锥形瓶内;氧气约占空气总体积的1/5,锥形瓶内空气的总体积为230mL,氧气的体积=
2P2O5 ;③白磷燃烧消耗氧气导致瓶内的压强减小,按下注射器,使注射器针头穿透橡皮塞,此时注射器里的硫酸铜溶液会自动喷入锥形瓶内;氧气约占空气总体积的1/5,锥形瓶内空气的总体积为230mL,氧气的体积= ![]() 1/5=46ml,即进入锥形瓶中的硫酸铜的体积为46ml,那么最终注射器里的液面约停留在4ml处;【反思评价】①反应前P:11x,Cu:60,S:60,H:192,O:336,反应后P:44,Cu:60,S:60,H:192,O:336,根据质量守恒定律化学反应前后原子的种类和数目不变,故x=4 ;②课本上“测量空气中氧气体积分数”原理是红磷燃烧消耗氧气,导致集气瓶内的压强减小,水倒流入集气瓶中的体积则为氧气的体积,此改进装置的优点是无污染、误差小、操作简便。
1/5=46ml,即进入锥形瓶中的硫酸铜的体积为46ml,那么最终注射器里的液面约停留在4ml处;【反思评价】①反应前P:11x,Cu:60,S:60,H:192,O:336,反应后P:44,Cu:60,S:60,H:192,O:336,根据质量守恒定律化学反应前后原子的种类和数目不变,故x=4 ;②课本上“测量空气中氧气体积分数”原理是红磷燃烧消耗氧气,导致集气瓶内的压强减小,水倒流入集气瓶中的体积则为氧气的体积,此改进装置的优点是无污染、误差小、操作简便。
所以答案是:4P+5O2 ![]() 2P2O5、自动喷入锥形瓶内、1/5(或21%)、4(或1.7)、4、无污染、误差小、操作简便等.
2P2O5、自动喷入锥形瓶内、1/5(或21%)、4(或1.7)、4、无污染、误差小、操作简便等.

 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案