��Ŀ����
��8�֣��ڽ������˳����������λ��Խ��ǰ�����Ļ�Ծ�Խǿ���ڻ�ѧ��Ӧ��Խ����ʧȥ���ӡ�
(1)Ca��Mg��K���ֽ����ڻ�ѧ��Ӧ��ʧȥ���ӵ�������ǿ������˳����__ _��
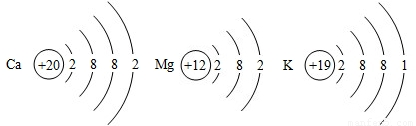
(2) Ca��Mg��K���ֽ�����ԭ�ӽṹʾ��ͼ����ͼ��ʾ��

����������ֽ�����ԭ�ӽṹʾ��ͼ�������ѧ�����й�ԭ�ӽṹ��֪ʶ�Ʋ⣺��������ʧȥ����������ǿ����Ҫ����Щ�����йأ� ���δ����㣩��
(3)��֤��Cu�Ľ�����Ա�Agǿ�ķ����ǣ� ���û�ѧ����ʽ��ʾ����
(4)�ǽ�������Ҳ�������ƽ���������Һ֮����û���Ӧ���ɣ�����Խ�ǿ�ķǽ����ɰѻ�Խ����ķǽ�����������Һ���û����������磬����Һ�пɷ������·�Ӧ�� Cl2 +2NaBr =2NaCl+ Br2;Br2 +2KI =2KBr +I2��;
I2 +Na2S =2NaI+S �ɴ˿����ж���(S)����( Br2)����(I2)������(Cl2)���ַǽ������ʵĻ��������ǿ��˳����� ��
��8�֣�(l)K>Ca>Mg(2)���������� ���Ӳ���
(3) Cu +2AgN03 =Cu(N03)2+2Ag (4)S<12<Br2<C12������<��<��<������
����:��

 ��1����Ԫ�¿�������ĩϵ�д�
��1����Ԫ�¿�������ĩϵ�д�