题目内容
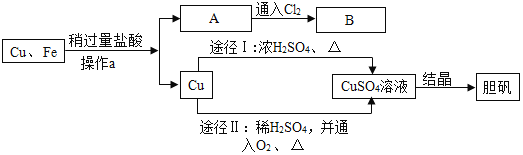
【题目】为了除去铜粉中混有的铁粉,并用提纯的铜粉制取胆矾(CuSO45H2O),某课外活动小组的同学按如下流程进行实验(反应中部分生成物已略去)。
已知:Cu+2H2SO4(浓![]() CuSO4+SO2↑+2H2O回答下列有关问题:
CuSO4+SO2↑+2H2O回答下列有关问题:
(1)操作a的名称是_____;除去铜粉中的铁粉,最简便的实验方法是_____。
(2)A溶液的溶质为_____,A到B的反应中,发生了化合反应,溶液最终变为黄色,则反应的方程式为_____。
(3)由Cu制CuSO4溶液的途径Ⅱ中,反应的方程式为_____(产物为硫酸铜和一种液体)。途径Ⅱ与途径Ⅰ相比较,其显著的优点是_____。
(4)硫酸铜溶液如何转化为胆矾(硫酸铜晶体):加热浓缩、_____。
【答案】过滤 用磁铁吸附 盐酸和氯化亚铁 ![]()
![]() 不产生有毒气体 蒸发结晶
不产生有毒气体 蒸发结晶
【解析】
(1)操作a是不溶性铜和液体分离,在实验室中该操作为过滤;除去铜粉中的铁粉,最简便的实验方法是用磁铁吸附。
(2)由于加入的盐酸过量,所以在生成氯化亚铁的同时还有剩余的盐酸,所以A溶液的溶质为剩余的盐酸和生成的氯化亚铁;A到B的反应中,发生了化合反应,氯化亚铁与氯气反应生成氯化铁,溶液最终变为黄色,则反应的方程式为![]() 。
。
(3)由Cu制硫酸铜溶液的途径Ⅱ中,加热条件下,铜、稀硫酸与氧气反应生成硫酸铜和水,反应的方程式为![]() 。通过对比反应,最明显的差别是途径I生成了有毒的二氧化硫,所以途径II与途径Ⅰ相比较,其显著的优点是不产生有毒气体。
。通过对比反应,最明显的差别是途径I生成了有毒的二氧化硫,所以途径II与途径Ⅰ相比较,其显著的优点是不产生有毒气体。
(4)硫酸铜溶液如何转化为胆矾(硫酸铜晶体):加热浓缩、蒸发结晶。

 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案【题目】小明取酸性锌锰干电池进行探究,他发现电池内部结构如右图所示。
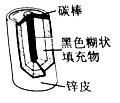
【查阅资料】(1)锌皮为金属锌(含有少量的铁)
(2)黑色糊状填充物由炭黑、MnO2、ZnC12和NH4Cl等组成
(3)有关数据见下表
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 | |
【实验探究一】小明取适量黑色糊状填充物,按下图所示实验流程进行探究。
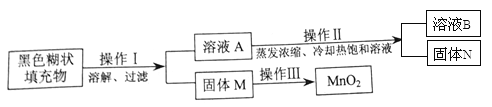
(1)溶液A 中溶质主要有______(填化学式),操作Ⅱ中采用冷却热饱和溶液的方法实现两者分离的依据是____________。
(2)欲从固体M 中得到较纯的MnO2,操作Ⅲ可采用的简便方法是____________。
【实验探究二】小明取电池外壳锌皮,用砂纸打磨干净,剪成小块,进行实验。
(1)取一块锌皮放入盛有适量稀盐酸的烧杯中,有ZnCl2生成。
① 实验中可观察到的现象是_________;该反应属于基本反应类型中的_________反应。
② 下列各组物质混合后,也能生成ZnCl2的有_________(填字母序号)。
A.ZnO与稀盐酸 B.ZnSO4溶液与BaC12溶液
C.ZnCO3与NaCl溶液 D.Zn(NO3)2溶液与NH4Cl溶液
(2)另取一块锌皮放入盛有一定量CuSO4溶液的烧杯中,充分反应后得到溶液E和固体F。当溶液E中只含一种溶质时,该溶质是________(填化学式);当固体F中只含一种物质时,溶液E中最少含有________种溶质。
(3)若将6.5g锌皮与足量稀硫酸完全反应,则生成氢气的质量________ 0.2g(选填“<”、“>”或“=”)。