题目内容
取10锌粉和铜粉的混合物于烧杯中,向烧杯中分四次加入等质量的同种稀硫酸,实验过程中得到如下数据.
(1)写出实验过程中发生反应的化学方程式: .
(2)混合物中铜粉的质量是 .
(3)计算所用稀硫酸中溶质的质量分数.(保留计算过程)
|
|
第1次 |
第2次 |
第3次 |
第4次 |
|
加入稀硫酸的质量 |
20g |
20g |
20g |
20g |
|
剩余固体的质量 |
8.7g |
7.4g |
6.1g |
5.5g |
(1)Zn+H2SO4═ZnSO4+H2↑;(2)5.5g;(3)所用稀硫酸中溶质的质量分数是9.8%.
【解析】
试题分析:(1)铜不与硫酸反应,混合物中只有锌与硫酸反应,生成硫酸锌和氢气,方程式是:Zn+H2SO4═ZnSO4+H2↑;
(2)由图表可知,每次加入的稀硫酸的质量相等,第1次加入20g稀硫酸固体减少了10g﹣8.7g=1.3g,说明20g稀硫酸恰好与1.3g锌反应,第4次加入20g稀硫酸固体减少了6.1g﹣5.5g=0.6g,说明混合物中的锌已反应完,剩余固体的质量就是混合物中铜的质量;
(3)第1次加入20g稀硫酸固体减少了10g﹣8.7g=1.3g,说明20g稀硫酸恰好与1.3g锌反应;
设第1次参加反应的硫酸的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 98
1.3g x
 =
=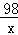
x=1.96g
 ×100%=9.8%
×100%=9.8%
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算.
点评:解答本题关键是要分析出第1次实验时硫酸全部参加反应,锌有剩余,根据锌的质量计算硫酸质量分数,重点考查了分析图表、获取信息,分析解决问题的能力.

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案取10锌粉和铜粉的混合物于烧杯中,向烧杯中分四次加入等质量的同种稀硫酸,实验过程中得到如下数据.
(1)写出实验过程中发生反应的化学方程式: .
(2)混合物中铜粉的质量是 .
(3)计算所用稀硫酸中溶质的质量分数.(保留计算过程)
|
|
第1次 |
第2次 |
第3次 |
第4次 |
|
加入稀硫酸的质量 |
20g |
20g |
20g |
20g |
|
剩余固体的质量 |
8.7g |
7.4g |
6.1g |
5.5g |
取10锌粉和铜粉的混合物于烧杯中,向烧杯中分四次加入等质量的同种稀硫酸,实验过程中得到如下数据.
(1)写出实验过程中发生反应的化学方程式: .
(2)混合物中铜粉的质量是 .
(3)计算所用稀硫酸中溶质的质量分数.(保留计算过程)
| 第1次 | 第2次 | 第3次 | 第4次 | |
| 加入稀硫酸的质量 | 20g | 20g | 20g | 20g |
| 剩余固体的质量 | 8.7g | 7.4g | 6.1g | 5.5g |
取10锌粉和铜粉的混合物于烧杯中,向烧杯中分四次加入等质量的同种稀硫酸,实验过程中得到如下数据.
(1)写出实验过程中发生反应的化学方程式: .
(2)混合物中铜粉的质量是 .
(3)计算所用稀硫酸中溶质的质量分数.(保留计算过程)
| 第1次 | 第2次 | 第3次 | 第4次 | |
| 加入稀硫酸的质量 | 20g | 20g | 20g | 20g |
| 剩余固体的质量 | 8.7g | 7.4g | 6.1g | 5.5g |