题目内容
现测得二氧化碳在空气中的含量为0.038%,当其含量超过0.05%时就会加剧温室效应。所以人们一方面想限制其排放量,另一方面又想对它进行再利用。
(1)目前有以超临界(一种介于气态和液态之间的状态)CO2作致冷剂(以前曾用氟利昂),这种做法对环境的积极意义在于____________________。
(2)空气中CO2的含量太低,不利于生成甲醇的反应进行。科学家提出回收利用CO2的构想:把空气吹入碳酸钾溶液,从溶液中提取出CO2,又在合成塔使之变为燃料甲醇(CH3OH)。该技术流程如下:
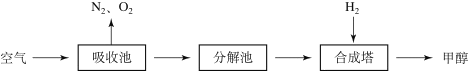
(说明:吸收池中盛有饱和的K2CO3溶液,合成塔内的反应条件为300℃、200kPa和催化剂。)
① 合成塔中反应的化学方程式为____________________。
③ 如果空气不经过吸收池和分解池,而是直接通入合成塔,你认为可行吗?并简述理由
。
④ 若生产6.4吨甲醇,则可回收空气中的CO2 吨。(请写出步骤,2分)
(1)目前有以超临界(一种介于气态和液态之间的状态)CO2作致冷剂(以前曾用氟利昂),这种做法对环境的积极意义在于____________________。
(2)空气中CO2的含量太低,不利于生成甲醇的反应进行。科学家提出回收利用CO2的构想:把空气吹入碳酸钾溶液,从溶液中提取出CO2,又在合成塔使之变为燃料甲醇(CH3OH)。该技术流程如下:
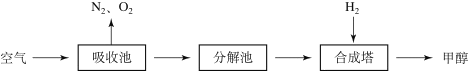
(说明:吸收池中盛有饱和的K2CO3溶液,合成塔内的反应条件为300℃、200kPa和催化剂。)
① 合成塔中反应的化学方程式为____________________。
③ 如果空气不经过吸收池和分解池,而是直接通入合成塔,你认为可行吗?并简述理由
。
④ 若生产6.4吨甲醇,则可回收空气中的CO2 吨。(请写出步骤,2分)
(1)保护臭氧层
(2)①CO2 +3H2=CH3OH + H2O
③ 不可行。 空气中CO2的含量太低,不利于生成甲醇的反应进行。
④ 8.8吨;
(2)①CO2 +3H2=CH3OH + H2O
③ 不可行。 空气中CO2的含量太低,不利于生成甲醇的反应进行。
④ 8.8吨;
试题分析:(1) 由于氟利昂能破坏臭氧层造成臭氧层空洞,故用二氧化碳代替氟利昂能保护臭氧层。
(2)①根据题意,“从溶液中提取出CO2,又在合成塔使之变为燃料甲醇”,再结合图示(向合成塔中加入氢气),
故合成塔中发生的反应是:二氧化碳和氢气在300℃、200kPa和催化剂的条件下反应,生成甲醇;故反应的化学方程式为CO2+3H2
 CH3OH+H2O。
CH3OH+H2O。③ 根据题意,空气中CO2的含量太低,不利于生成甲醇的反应进行,故通过吸收池和分解池就是为了加大二氧化碳的浓度,之后再通入合成塔。
④解:设可回收CO2的质量为x吨。
CO2 +3H2
 CH3OH + H2O
CH3OH + H2O44 32
x 6.4吨
44:32= x:6.4吨
解得x=8.8吨
答:可回收CO28.8吨。
点评:本题难度不大,但涉及的知识点较多,关于化学方程式的简单计算,只要注意有完整的计算步骤、规范的书写格式即可;根据题中的条件对化学方程式的推理,是本题的重点,解答时要注意仔细审题。

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目

