题目内容
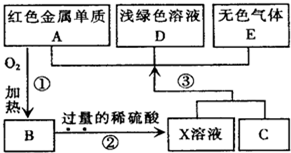 A、B、C、D、E为初中化学常见的物质,其中A、C为金属单质,E为非金属单质,如图是它们之间的相互转化关系.请回答:
A、B、C、D、E为初中化学常见的物质,其中A、C为金属单质,E为非金属单质,如图是它们之间的相互转化关系.请回答:(1)反应①的基本反应类型是
化合反应
化合反应
;反应②的基本反应类型是复分解反应
复分解反应
.(2)A的化学式为
Cu
Cu
; E的化学式为H2
H2
.(3)写出物质E和B在加热条件下反应的化学方程式
H2+CuO
Cu+H2O
| ||
H2+CuO
Cu+H2O
;
| ||
(4)如图转化中产生无色气体E的原因是
稀硫酸过量
稀硫酸过量
;(5)写出反应③中发生反应的化学方程式:
Fe+H2SO4=FeSO4+H2↑、
Fe+H2SO4=FeSO4+H2↑、
、Fe+CuSO4=FeSO4+Cu
Fe+CuSO4=FeSO4+Cu
.分析:可根据物质或离子的颜色初步推断物质的成分,通过关键词,如“单质”、“过量”,来判断物质的组成或溶液中溶质的组成.
解答:解:红色物质是铜和氧化铁,A为金属单质,则A为铜;铜在加热的条件下生成氧化铜,则B为氧化铜,该反应由两种物质生成一种物质,反应类型为化合反应.氧化铜与稀硫酸反应生成硫酸铜和水,属于复分解反应,故X溶液为硫酸铜溶液,C为金属单质,能与硫酸铜溶液反应生成浅绿色溶液,故C为铁,铁与过量的硫酸反应生成氢气;
(1)由上述分析可知,反应①为铜在加的条件下与氧气反应生成氧化铜,属于化合反应;反应②为氧化铜与硫酸反应生成硫酸铜和水,属于复分解反应;
(2)A为铜,化学式为Cu;无色气体E为 H2
(3)E与B在加热条件下反应,即氢气与氧化铜在加热条件下反应,化学方程式为H2+CuO
Cu+H2O
(4)B与过量稀硫酸反应,即氧化铜与稀硫酸反应,生成硫酸铜和水;稀硫酸过量,则X溶液中有两种溶质,即生成的硫酸铜和过量的稀硫酸.铁与稀硫酸反应会生成氢气.
(5)③中的化学反应是铁与过量的稀硫酸反应产生氢气、铁与硫酸铜反应生成铜和硫酸亚铁,则化学方程式为:
Fe+H2SO4=FeSO4+H2↑、Fe+CuSO4=FeSO4+Cu
故答案为:(1)化合反应 复分解反应(2)Cu H2
(3)H2+CuO
Cu+H2O
(4))稀硫酸过量 (5)Fe+H2SO4=FeSO4+H2↑、Fe+CuSO4=FeSO4+Cu
(1)由上述分析可知,反应①为铜在加的条件下与氧气反应生成氧化铜,属于化合反应;反应②为氧化铜与硫酸反应生成硫酸铜和水,属于复分解反应;
(2)A为铜,化学式为Cu;无色气体E为 H2
(3)E与B在加热条件下反应,即氢气与氧化铜在加热条件下反应,化学方程式为H2+CuO
| ||
(4)B与过量稀硫酸反应,即氧化铜与稀硫酸反应,生成硫酸铜和水;稀硫酸过量,则X溶液中有两种溶质,即生成的硫酸铜和过量的稀硫酸.铁与稀硫酸反应会生成氢气.
(5)③中的化学反应是铁与过量的稀硫酸反应产生氢气、铁与硫酸铜反应生成铜和硫酸亚铁,则化学方程式为:
Fe+H2SO4=FeSO4+H2↑、Fe+CuSO4=FeSO4+Cu
故答案为:(1)化合反应 复分解反应(2)Cu H2
(3)H2+CuO
| ||
(4))稀硫酸过量 (5)Fe+H2SO4=FeSO4+H2↑、Fe+CuSO4=FeSO4+Cu
点评:本题主要考查了反应的基本类型、物质和离子的颜色、化学方程式的书写及正确分析实验方面的内容.

练习册系列答案
相关题目
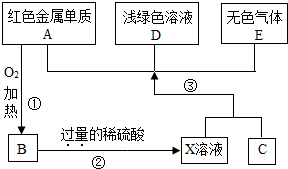 A、B、C、D、E为初中化学常见的物质,其中A、C为金属单质,E为非金属单质,下图是它们之间的相互转化关系.请回答:
A、B、C、D、E为初中化学常见的物质,其中A、C为金属单质,E为非金属单质,下图是它们之间的相互转化关系.请回答: 16、A、B、C、D、E为初中化学常见的物质,其中A、C为金属单质,E为非金属单质,如图是它们之间的相互转化关系.请回答:
16、A、B、C、D、E为初中化学常见的物质,其中A、C为金属单质,E为非金属单质,如图是它们之间的相互转化关系.请回答: