题目内容
4g某正三价金属R的氧化物与21g稀硫酸恰好完全反应,反应后所得溶液的溶质的质量分数为40%,计算:(1)R的相对原子质量.______
(2)稀硫酸的溶质质量分数.______.
【答案】分析:金属氧化物与酸发生复分解反应,反应前后元素化合价不变,因此某正三价金属R的氧化物与稀硫酸恰好完全反应生成R2(SO4)3和H2O;根据质量守恒定律,求得反应后所得溶液的质量,从而可确定反应生成R2(SO4)3的质量;根据反应的化学方程式,由生成物的质量可计算R的相对原子质量及反应消耗硫酸质量,即可完成计算.
解答:解:设R的相对原子质量为r,反应消耗硫酸的质量为x
恰好完全反应后生成R2(SO4)3的质量=(4g+21g)×40%=10g
R2O3 +3H2SO4═R2(SO4)3+3H2O
2r+48 294 2r+288
4g x 10g
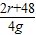 =
=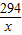 =
=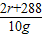
r=56,x=7.35g
稀硫酸的溶质质量分数= ×100%=35%
×100%=35%
故答案为:
(1)56;
(2)35%.
点评:明确金属氧化物与酸发生反应的反应特点,确定反应的化学方程式,是进行计算的基础.
解答:解:设R的相对原子质量为r,反应消耗硫酸的质量为x
恰好完全反应后生成R2(SO4)3的质量=(4g+21g)×40%=10g
R2O3 +3H2SO4═R2(SO4)3+3H2O
2r+48 294 2r+288
4g x 10g
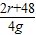 =
=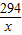 =
=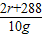
r=56,x=7.35g
稀硫酸的溶质质量分数=
 ×100%=35%
×100%=35%故答案为:
(1)56;
(2)35%.
点评:明确金属氧化物与酸发生反应的反应特点,确定反应的化学方程式,是进行计算的基础.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目