题目内容
某同学进行镁与稀硫酸反应的实验,其五次实验结果如下表
试回答下列问题:
(1)上表中第2次实验产生 g硫酸镁;
(2)根据上表判断 次实验中有过剩的镁;
(3)请通过化学方程式计算,与70mL硫酸恰好完全反应,需要镁的质量是多少?
| 次数 | 镁(g) | 硫酸(mL) | 硫酸镁(g) |
| 1 | 2 | 70 | 10 |
| 2 | 4 | 70 | ? |
| 3 | 6 | 70 | 30 |
| 4 | 8 | 70 | 31.2 |
| 5 | 10 | 70 | ? |
(1)上表中第2次实验产生
(2)根据上表判断
(3)请通过化学方程式计算,与70mL硫酸恰好完全反应,需要镁的质量是多少?
考点:根据化学反应方程式的计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:根据表中提供的数据可以进行分析、判断,从而发现物质的变化规律,由1可知2g镁可生成硫酸镁10g,所以可判断镁的不足情况,酸有剩余即镁完全反应后酸还有剩余的过程,利用表中的数据分析可完成相关的判断.
解答:解:(1)由1可知2g镁可生成硫酸镁10g,由3可知随着金属镁的质量增加,生成硫酸镁的质量还在增加,所以说明2中金属完全反应,酸有剩余,所以4g金属镁反应可生成硫酸镁的质量为20g;故填:20;
(2)由1可知2g镁完全反应可生成硫酸镁10g,所以实验4中如果8g金属镁完全反应应该生成40g硫酸镁,而事实却生成31.2g硫酸镁.说明镁没有完全反应,硫酸已经完全反应,所以实验5中金属也有剩余;故填:4、5;
(3)与70mL硫酸恰好完全反应时生成硫酸镁的质量为31.2g,需要镁的质量为x.
Mg+H2SO4═MgSO4+H2↑
24 120
x 31.2g
=
x=6.24g
答:需要镁的质量是6.24g.
(2)由1可知2g镁完全反应可生成硫酸镁10g,所以实验4中如果8g金属镁完全反应应该生成40g硫酸镁,而事实却生成31.2g硫酸镁.说明镁没有完全反应,硫酸已经完全反应,所以实验5中金属也有剩余;故填:4、5;
(3)与70mL硫酸恰好完全反应时生成硫酸镁的质量为31.2g,需要镁的质量为x.
Mg+H2SO4═MgSO4+H2↑
24 120
x 31.2g
| 24 |
| x |
| 120 |
| 31.2g |
x=6.24g
答:需要镁的质量是6.24g.
点评:该题是对数据分析知识的考查,解题的关键是找到数据中反应的相关规律,是一道训练学生思维能力的综合知识考查题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列物质中,不属于氧化物的是( )
| A、O2 |
| B、H2O |
| C、CO2 |
| D、H2O2 |
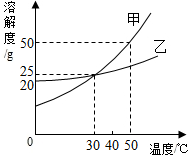 如图所示为甲、乙两物质(均不含结晶水)的溶解度曲线.请根据曲线回答以下问题:
如图所示为甲、乙两物质(均不含结晶水)的溶解度曲线.请根据曲线回答以下问题: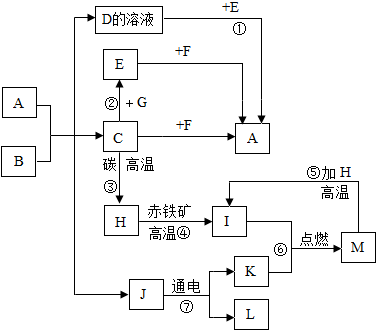 A~M均为初中化学常见物质,其中A是大理石主要成分,B是人体胃酸的一种主要成分,F是澄清石灰水主要成分,E是钠盐,它们之间有如图所示的相互转换关系(图中部分生成物已略去).
A~M均为初中化学常见物质,其中A是大理石主要成分,B是人体胃酸的一种主要成分,F是澄清石灰水主要成分,E是钠盐,它们之间有如图所示的相互转换关系(图中部分生成物已略去).