题目内容
 (2012?六合区一模)实验室需配制4%的氢氧化钠溶液200g,并用此溶液测定某盐酸溶液的溶质质量分数.
(2012?六合区一模)实验室需配制4%的氢氧化钠溶液200g,并用此溶液测定某盐酸溶液的溶质质量分数.(1)配制200g质量分数为4%的氢氧化钠溶液.需要氢氧化钠固体的质量为
8
8
g.(2)配制过程中除了用到天平、烧杯、量筒、胶头滴管外,还需用到的玻璃仪器是
玻璃棒
玻璃棒
,其作用是
搅拌,加速溶解
搅拌,加速溶解
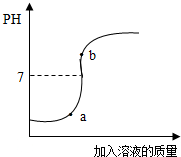
.(3)用配得的氢氧化钠溶液与待测溶质质量分数的盐酸溶液反应,实验过程中溶液的pH变化曲线如图所示:
①要得到此变化曲线,所进行的操作是
B
B
(填字母).A.将盐酸溶液滴加到氢氧化钠溶液中
B.将氢氧化钠溶液滴加到盐酸溶液中
②b点对应的溶液中的溶质为
NaCl、NaOH
NaCl、NaOH
(写化学式).(4)恰好完全反应时,消耗4%的氢氧化钠溶液20g和25g某质量分数盐酸溶液,试计算该盐酸溶液中溶质的质量分数(请写出计算过程).
设该盐酸溶质的质量分数为x
NaOH+HCl=NaCl+H2O
40 36.5
20g×4% 25gx
=
x=2.92%
NaOH+HCl=NaCl+H2O
40 36.5
20g×4% 25gx
| 40 |
| 36.5 |
| 20g×4% |
| 25gx |
x=2.92%
设该盐酸溶质的质量分数为x
NaOH+HCl=NaCl+H2O
40 36.5
20g×4% 25gx
=
x=2.92%
.NaOH+HCl=NaCl+H2O
40 36.5
20g×4% 25gx
| 40 |
| 36.5 |
| 20g×4% |
| 25gx |
x=2.92%
分析:(1)根据溶质的质量分数的计算公式可求出氢氧化钠的质量;
(2)配制溶液时要用玻璃棒不断搅拌,加速固体溶质的溶解;
(3)根据pH的变化情况判断酸碱的相互滴加情况和混合液中的溶质成分;
(4)当pH=7时,两者恰好完全反应,利用图象和此时参加反应的氢氧化钠溶液的质量;然后利用化学方程式的计算可求出参加反应的盐酸中氯化氢的质量,从而计算出其溶质的质量分数.
(2)配制溶液时要用玻璃棒不断搅拌,加速固体溶质的溶解;
(3)根据pH的变化情况判断酸碱的相互滴加情况和混合液中的溶质成分;
(4)当pH=7时,两者恰好完全反应,利用图象和此时参加反应的氢氧化钠溶液的质量;然后利用化学方程式的计算可求出参加反应的盐酸中氯化氢的质量,从而计算出其溶质的质量分数.
解答:解:(1)需要氢氧化钠固体的质量为:200g×4%=8g,则需要水的质量为:200g-8g=192g,合192ml.
(2)配制溶液的过程中除了用到天平、烧杯、量筒、胶头滴管外,还需用用玻璃棒不断搅拌,以加速固体溶质的溶解.
(3)①pH变化曲线由小到大,所以是向盐酸中加氢氧化钠溶液.
②b点对应的溶液的pH大于7,说明此时氢氧化钠已经过量,故溶液中的溶质为:NaCl、NaOH.
(4)恰好完全反应时,消耗4%的氢氧化钠溶液20g和25g某质量分数盐酸溶液,设该盐酸溶质的质量分数为x
NaOH+HCl=NaCl+H2O
40 36.5
20g×4% 25gx
=
x=2.92%
故答案为:(1)8;
(2)玻璃棒;搅拌,加速溶解;
(3)①B ②NaCl、NaOH
(4)设该盐酸溶质的质量分数为x
NaOH+HCl=NaCl+H2O
40 36.5
20g×4% 25gx
=
x=2.92%
(2)配制溶液的过程中除了用到天平、烧杯、量筒、胶头滴管外,还需用用玻璃棒不断搅拌,以加速固体溶质的溶解.
(3)①pH变化曲线由小到大,所以是向盐酸中加氢氧化钠溶液.
②b点对应的溶液的pH大于7,说明此时氢氧化钠已经过量,故溶液中的溶质为:NaCl、NaOH.
(4)恰好完全反应时,消耗4%的氢氧化钠溶液20g和25g某质量分数盐酸溶液,设该盐酸溶质的质量分数为x
NaOH+HCl=NaCl+H2O
40 36.5
20g×4% 25gx
| 40 |
| 36.5 |
| 20g×4% |
| 25gx |
x=2.92%
故答案为:(1)8;
(2)玻璃棒;搅拌,加速溶解;
(3)①B ②NaCl、NaOH
(4)设该盐酸溶质的质量分数为x
NaOH+HCl=NaCl+H2O
40 36.5
20g×4% 25gx
| 40 |
| 36.5 |
| 20g×4% |
| 25gx |
x=2.92%
点评:做这类题目要会看折点,折点是指图象在变化过程中方向发生了大的转变的那个点.它的出现往往是两个变量中某一变量单方面停止造成的.如果图象涉及化学反应,折点通常是该反应的结束点.对折点的分析关键在于理解该点坐标的含义.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
 (2012?六合区一模)如图中直线相连物质间在一定条件下可以发生反应.下表提供的四组物质符合图中要求的是( ) (2012?六合区一模)如图中直线相连物质间在一定条件下可以发生反应.下表提供的四组物质符合图中要求的是( )
|
 (2012?六合区一模)根据如图所示的溶解度曲线,判断下列说法中正确的是( )
(2012?六合区一模)根据如图所示的溶解度曲线,判断下列说法中正确的是( )