题目内容
【题目】提纯含少量泥沙的粗盐样品,实验过程和氯化钠的溶解度数据如下:
![]()
(1)该实验操作Ⅰ名称是________;
(2)蒸发时,一般有如下操作:①放置酒精灯,②放置蒸发皿,③加热并搅拌,④固定铁圈位置,⑤停止加热,用余热蒸干。正确的操作顺序是_______________;
(3)经称量,未溶解的粗盐质量为1.2g,得到精盐的质量为2.7g。则粗盐的产率是________。(结果保留一位小数)下列因素会导致获得的精盐质量偏小的是________(填序号)
A蒸发时液滴溅出 B过滤时,滤纸破损
(4)由于粗盐中含有少量![]() 、
、![]() 、
、![]() 等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制,流程如图:
等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制,流程如图:
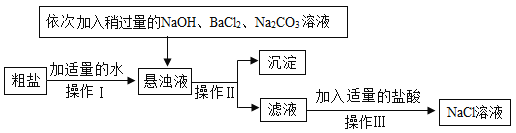
①加入稍过量的![]() 溶液能除去粗盐中的
溶液能除去粗盐中的![]() ,反应的化学方程式为_____________________。
,反应的化学方程式为_____________________。
②通过操作Ⅱ所得滤液中的溶质有____________________(用化学式表示)。
【答案】过滤 ①④②③⑤ 71.1% A ![]() NaCl、NaOH、
NaCl、NaOH、![]()
【解析】
(1)粗盐提纯的操作步骤是:溶解、过滤、蒸发,因此实验操作Ⅰ的名称是:过滤。
(2)实验装置安装一般是从左到右,由下而上。因此蒸发时正确的操作顺序是:①④②③⑤ 。
(3)经称量,未溶解的粗盐质量为1.2g,得到精盐的质量为2.7g。则粗盐的产率是:![]() ≈71.1%。蒸发时液滴溅出,液滴中含有氯化钠,会导致得到的氯化钠质量减少,过滤时,滤纸破损只会造成滤液浑浊,得到的氯化钠不纯,因此会导致获得的精盐质量偏小的是:A。
≈71.1%。蒸发时液滴溅出,液滴中含有氯化钠,会导致得到的氯化钠质量减少,过滤时,滤纸破损只会造成滤液浑浊,得到的氯化钠不纯,因此会导致获得的精盐质量偏小的是:A。
(4)①粗盐精制过程中加入稍过量的BaCl2溶液能除去粗盐中的Na2SO4,反应的化学方程式为:BaCl2+ Na2SO4=BaSO4↓+2NaCl。
②因为镁离子、钙离子、硫酸根离子、过量的钡离子都被除去,而氢氧化钠、碳酸钠有剩余,因此通过操作Ⅱ所得滤液中的溶质有:NaCl、NaOH、Na2CO3。

【题目】下列实验指定容器中的水,其解释没有体现水的主要作用的是( )
A | B | C | D | |
实 验 装 置 |
硫在氧气中燃烧 |
测定空气中氧气含量 |
铁丝在氧气中燃烧 |
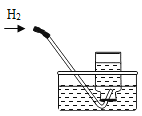
排水法收集氢气 (氢气难溶于水) |
解释 | 集气瓶中的水:吸收放出的热量 | 量筒中的水:通过水体积的变化得出O2体积 | 集气瓶中的水:冷却溅落融熔物,防止集气瓶炸裂 | 集气瓶中的水:水先将集气瓶内的空气排净,后便于观察氢气何时收集满 |
A.AB.BC.CD.D
【题目】下列说法完全正确的是
A. | 氖气的化学式 — Ne2 1个硅原子 — Si 1个钠离子 —— | B. | 决定元素种类——质子数 决定元素的化学性质——最外层电子数 决定元素周期表元素排列顺序——质子数 |
C. | 铁——由分子构成 二氧化碳——由原子构成 氯化钠——由离子构成 | D. | 分子——化学变化中的最小粒子 原子——保持物质化学性质的最小粒子 离子——带电的原子 |
A. A B. B C. C D. D