题目内容
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2 、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下: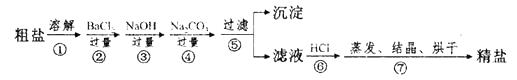
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是。
(2)第②步操作的目的是除去粗盐中的(填化学式,下同),第⑥步操作的目的是除去滤液中。
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH) 2、 (填化学式)。
(4)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是。
(5)在制备精盐的过程中,氯化钡和碳酸钠溶液的添加顺序是否可以颠倒 ,
理由是;
(6)在利用粗盐制备精盐过程的第⑥步操作中,加入适量盐酸的目的是 。
【答案】
(1)加快溶解
(2)Na2SO4,氢氧化钠和碳酸钠
(3)CaCO3、BaCO3
(4)会产生新的杂质氯化钾
(5)不可以,碳酸钠会除掉过量的氯化钙和氯化钡
(6)除掉过量的氢氧化钠和碳酸钠
【解析】(1)用玻璃棒搅拌,加速了液体的流动,使固体很快溶解;
(2)加入过量的氯化钡,氯离子对氯化钠来说不是杂质,钡离子可以将硫酸根离子转化为沉淀,第②步操作加入过量的BaCl2目的是除去粗盐中的硫酸钠,反应的化学方程式Na2SO4+BaCl2=BaSO4↓+2NaCl;最后得到的滤液中溶质除含有氯化钠外还含有碳酸钠和氢氧化钠,利用粗盐制备精盐过程的第⑥步操作中,加入适量盐酸的目的是除去多余的氢氧化钠和碳酸钠;
(3)第二步后溶液中剩下没有反应的氯化钡,第四步加入碳酸钠,除了将氯化钙沉淀以外,还可以除去过量的氯化钡,故第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、CaCO3、BaCO3、Mg(OH)2;
(4)氢氧化钾会与氯化镁反应生成氢氧化镁沉淀和氯化钾,氯化钾对氯化钠来说就是杂质了,在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是会引入新的杂质氯化钾;
(5)在制备精盐的过程中,氯化钡和碳酸钠溶液的添加顺序不可以颠倒,理由是:碳酸钠的作用是既可以除去钙离子,又会除去多余的氯化钡;
(6)最后得到的滤液中溶质除含有氯化钠外还含有碳酸钠和氢氧化钠,利用粗盐制备精盐过程的第⑥步操作中,加入适量盐酸的目的是除去多余的氢氧化钠和碳酸钠.
所以答案是:(1)加快粗盐溶解;(2)Na2SO4,NaOH和Na2CO3;(3)CaCO3、BaCO3;(4)会引进新的杂质KCl;(5)不可以,碳酸钠的作用是既可以除去钙离子,又会除去多余的氯化钡;(6)除去多余的氢氧化钠和碳酸钠.

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案