题目内容
【题目】氨气(NH3)是一种无色、有刺激性气味的气体,极易溶于水,它的水溶液称为氨水,显碱性。氨气在化学工业中用途很广泛,例如制化肥、制纯碱等;近年来,氨气还用于环境治理。
(1)在400℃左右,有催化剂存在的条件下,用氨气可将有毒气体NO还原为N2和H2O。试写出该反应的化学方程式 。
(2)“侯氏制碱法”关键一步的反应原理可表示为:NaCl+H2O+NH3+CO2=NaHCO3+NH4Cl,其生成物NH4Cl的相对分子质量为 ,NH4Cl中氮元素的质量分数为 (精确到0.1%)。若上述NH4Cl中氮元素的质量为2.8t,则NH4Cl的质量为 t。(精确到0.1)
(3)在细菌作用下,用氨气处理含甲醇的工业废水,使其变为无毒的N2和CO2,从而清除对环境的污染,有关的反应为:6NH3+5CH3OH+12X ![]() 3N2+5CO2+19H2O,上述反应的X处应填入的化学式为 。
3N2+5CO2+19H2O,上述反应的X处应填入的化学式为 。
【答案】(1)4NH3+6NO ![]() 5N2+6H2O
5N2+6H2O
(2)53.5 26.2% 10.7 (3)O2
【解析】
试题分析:(1)在400℃左右,有催化剂存在的条件下,用氨气可将有毒气体NO还原为N2和H2O。由于反应物、生成物都已知,只需直接配平即可,该反应的化学方程式为:4NH3+6NO ![]() 5N2+6H2O
5N2+6H2O
(2)NH4Cl的相对分子质量=14+1×4+35.5=53.5;NH4Cl中氮元素的质量分数=14/53.5×100%=26.2%;根据元素质量=物质质量×该元素的质量分数。NH4Cl中氮元素的质量为2.8t,则NH4Cl的质量=2.8t÷14/53.5×100%=10.7 t
(3)根据质量守恒定律的微观解释:在化学反应前后,原子的种类、数目都不变,结合化学反应:6NH3+5CH3OH+12X ![]() 3N2+5CO2+19H2O,可以推出X化学式为O2
3N2+5CO2+19H2O,可以推出X化学式为O2

【题目】某兴趣小组在学习碱的化学性质时,进行了如图所示的实验。
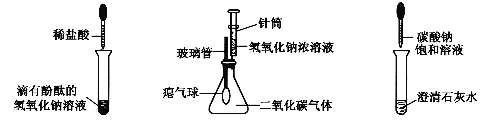
实验后,同学们将三个实验的废液倒入同一废液缸中,最终看到废液浑浊并呈红色。
【提出问题】废液中含有哪些物质?
【交流讨论】(1)一定含有的物质:碳酸钙、指示剂、水和。
(2)还含有能使废液呈碱性的物质。能使废液呈碱性的物质是什么?
猜想1:只有碳酸钠。猜想2:只有氢氧化钙。
猜想3:是氢氧化钠和碳酸钠。你的猜想:还可能是。
【实验设计】小斌想用氯化钙溶液来验证他们的猜想。查阅资料获悉氯化钙溶液呈中性,并设计如下实验。请你将小斌的实验设计补充完整。
实验内容 | 预计现象 | 预计结论 |
取少量废液缸中上层清液于试管中,加入过量的氯化钙溶液,静置。 | ①有白色沉淀生成,溶液呈红色 | 猜想3正确。 |
② | 正确。 | |
③ | 正确。 |
【反思拓展】
在分析化学反应后所得物质的成分时,除考虑生成物外还需考虑。




