题目内容
10毫升密度为1.84克/厘米3,质量分数为98.0%的浓H2SO4与40毫升水充分混合后,求:
(1)所得稀硫酸的溶质质量分数为多少?
(2)该稀H2SO4能与多少克锌恰好完全反应?(水的密度为1.0克/厘米3)
解:(1)H2SO4的质量=10mL×1.84g/cm3×98.0%=18.032g
稀H2SO4溶液的质量=10mL×1.84g/cm3+40mL×1g/cm3=58.4g
稀H2SO4溶液中溶质的质量分数=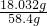 ×100%≈31%
×100%≈31%
(2)设需要Zn的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 98
x 10mL×1.84g/cm3×98.0%
 =
= x=12.0g
x=12.0g
答:(1)所得稀硫酸的溶质质量分数为31%;
(2)该稀H2SO4能与12.0g锌恰好完全反应.
分析:(1)利用质量与体积的转化关系,确定混合后所得稀硫酸中溶质质量与溶液质量,计算所得稀硫酸的溶质质量分数;
(2)根据硫酸与锌反应的化学方程式,由硫酸的质量可计算反应所消耗锌的质量.
点评:对浓硫酸加水稀释时,溶液中溶质硫酸的质量不变,利用反应的化学方程式由硫酸的质量计算反应消耗锌的质量.
稀H2SO4溶液的质量=10mL×1.84g/cm3+40mL×1g/cm3=58.4g
稀H2SO4溶液中溶质的质量分数=
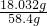 ×100%≈31%
×100%≈31%(2)设需要Zn的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 98
x 10mL×1.84g/cm3×98.0%
 =
= x=12.0g
x=12.0g答:(1)所得稀硫酸的溶质质量分数为31%;
(2)该稀H2SO4能与12.0g锌恰好完全反应.
分析:(1)利用质量与体积的转化关系,确定混合后所得稀硫酸中溶质质量与溶液质量,计算所得稀硫酸的溶质质量分数;
(2)根据硫酸与锌反应的化学方程式,由硫酸的质量可计算反应所消耗锌的质量.
点评:对浓硫酸加水稀释时,溶液中溶质硫酸的质量不变,利用反应的化学方程式由硫酸的质量计算反应消耗锌的质量.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用2%的氢氧化钠溶液进行中和,当溶液pH=7时,用去氢氧化钠溶液20g.计算废水中盐酸的溶质质量分数.
在测定时,有同学发现在反应过程中,溶液有温度的变化,于是他们进一步进行了探究.
(1)①计算废水中盐酸的溶质质量分数 .
②配制100mL10%的盐酸(密度为1.05g/cm3).他们应量取38%的盐酸(密度为1.19g/cm3)多少毫升 mL.
(2)在一定体积的10%的氢氧化钠溶液中,慢慢滴入上述配制的10%的盐酸.有关实验中的数据记录如
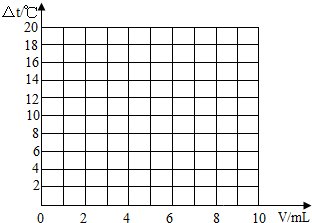
试在坐标系中绘出溶液温度变化与加入盐酸体积之间的变化关系图.
(3)根据(2)中关系图,请你从能量变化的角度谈谈对中和反应的认识. .
在测定时,有同学发现在反应过程中,溶液有温度的变化,于是他们进一步进行了探究.
(1)①计算废水中盐酸的溶质质量分数
②配制100mL10%的盐酸(密度为1.05g/cm3).他们应量取38%的盐酸(密度为1.19g/cm3)多少毫升
(2)在一定体积的10%的氢氧化钠溶液中,慢慢滴入上述配制的10%的盐酸.有关实验中的数据记录如
| 加入盐酸的体积(V)/mL | 2 | 4 | 6 | 8 | 10 |
| 溶液温度变化(△t)/℃ | 5.2 | 9.6 | 13.0 | 16.0 | 18.2 |

(3)根据(2)中关系图,请你从能量变化的角度谈谈对中和反应的认识.
单晶硅是重要的半导体材料,是我市的拳头产品,我市某厂生产的单晶硅曾用于制造我国的第一颗人造卫星.在硅及相关产品的生产中排放的废水含有HCl.该厂化验员对本厂排放废水中HCl的质量分数进行测定:将20毫升废水(假定其密度为1克/厘米3)样品置于锥形瓶中,用质量分数为1%的氢氧化钠溶液进行中和,共用去氢氧化钠溶液8克(假设废水中不含其他能与氢氧化钠溶液反应的物质).
(1)计算该废水中含HCl的质量分数.
(2)该厂每天产生废水100吨,若直接排放将对环境造成污染,必须进行无害化处理后才能进行排放,现准备用氢氧化钙粉末或质量分数为10%的氢氧化钠溶液进行中和.有关数据如下表所示:
你将选择 (写化学式)来中和废水中的HCl,请说明理由 .
(1)计算该废水中含HCl的质量分数.
(2)该厂每天产生废水100吨,若直接排放将对环境造成污染,必须进行无害化处理后才能进行排放,现准备用氢氧化钙粉末或质量分数为10%的氢氧化钠溶液进行中和.有关数据如下表所示:
| 物质 | 物质(或溶质)的相对分子质量 | 市场参考价(元/吨) |
| 氢氧化钙粉末 | 74 | 200 |
| 10%的氢氧化钠溶液 | 40 | 100 |
 (2005?海门市)某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用2%的氢氧化钠溶液进行中和,当溶液pH=7时,用去氢氧化钠溶液20g.计算废水中盐酸的溶质质量分数.
(2005?海门市)某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用2%的氢氧化钠溶液进行中和,当溶液pH=7时,用去氢氧化钠溶液20g.计算废水中盐酸的溶质质量分数.