题目内容
【题目】据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染.同学们对废旧手机中的金属回收产生兴趣. 
【提出问题】从废旧手机中可以回收到哪些有价值的金属?如何回收?
【查阅资料】
i.手机电路板中的金属及其价格如下表所示:
种类 | Fe | Cu | Al | Ni | Au | Ag | Pd(钯) |
市场价格($/t) | 365 | 7175.5 | 1710.5 | 14235 | 4.7×107 | 7.6×105 | 2.7×107 |
矿石中含量 | 72.4 | 0.87 | 29.1 | 1.02 | 4 | 120 | 0.4 |
手机电路板中含量 | 5 | 13 | 1 | 0.1 | 350 | 1380 | 210 |
说明:Fe、Cu、Al、Ni的含量用质量分数(%)表示,Au、Ag、Pd的含量的单位为“g/t”.
ii.Ni的金属活动性位于氢前;Pd的金属活动性位于氢后; NiCl2溶液为绿色.
Iii. 2Cu+O2+2H2SO4 2CuSO4+2H2O
(1)【实验方案】 第一步:选择值得回收的金属.
依据资料i中的数据,废旧手机中有回收价值的金属有Au、Ag、Cu、Pd,原因是:①
它们的市场价格较高;② .
第二步:设计实验分离、回收部分金属.
序号 | 实验步骤 | 实验现象 |
I | 取一废旧手机电路板,用电吹风机靠近电路焊接点的焊锡吹热风,一段时间后,用镊子将金属电路从塑料板中拽出 | 焊锡熔化 |
II | 将金属电路放入烧杯中,加入足量稀盐酸浸泡 | 。 |
III | 取II中未溶解的金属电路,用蒸馏水洗净后,放入如右图所示装置中,进行实验. | 溶液逐渐变成蓝色,仍有微量金属固体未溶解 |
IV | 过滤III中烧杯中的物质,洗涤滤纸上的物质 | 滤纸上仍有微量金属固体 |
V | 。 | 得到红色固体 |
(2)【问题讨论】 ①由步骤I中的现象,可推知的焊锡的物理性质是 .
②步骤II对应的实验现象是 .
③步骤II所得溶液中,一定含有的金属元素 .
④步骤V的操作是 .
(3)【反思交流】 为了确认步骤IV中滤纸上的金属成分,应进一步查阅的资料为 .
【答案】
(1)Au、Ag、Cu、Pd在收集电路板中的含量高于其在矿石中的含量;溶液变成绿色,有无色气泡产生;向IV中得到的滤液中加入铁片.
(2)熔点较低;溶液变成绿色,有无色气泡产生;Fe、Al、Ni;向IV中得到的滤液中加入铁片
(3)Au、Ag、Pd在加热条件下,能否与氧气、稀硫酸发生反应
【解析】解:【实验方案】②Au、Ag、Cu、Pd在收集电路板中的含量高于其在矿石中的含量.【问题讨论】①由步骤I中的现象焊锡熔化,可推知的焊锡的物理性质是熔点低.②将金属电路放入烧杯中,加入足量稀盐酸浸泡,铁与盐酸反应生成氯化亚铁和氢气,氯化亚铁溶液是绿色的,镍与盐酸反应生成NiCl2溶液也为绿色,步骤II对应的实验现象是溶液变成绿色,有无色气泡产生.③将金属电路放入烧杯中,加入足量稀盐酸浸泡,因为Fe、Al、Ni排在氢的前面,因此步骤II所得溶液中,一定含有的金属元素是Fe、Al、Ni.④因为现象是得到红色固体,因此步骤V的操作是向IV中得到的滤液中加入铁片,铁置换出硫酸铜中的铜.
【反思交流】为了确认步骤IV中滤纸上的金属成分,还应知道Au、Ag、Pd在加热条件下,能否与氧气、稀硫酸发生反应.
故填:【实验方案】②Au、Ag、Cu、Pd在收集电路板中的含量高于其在矿石中的含量;溶液变成绿色,有无色气泡产生;向IV中得到的滤液中加入铁片.
【问题讨论】①熔点较低;②溶液变成绿色,有无色气泡产生; ③Fe、Al、Ni;④向IV中得到的滤液中加入铁片;【反思交流】Au、Ag、Pd在加热条件下,能否与氧气、稀硫酸发生反应.
【考点精析】掌握金属材料的选择依据是解答本题的根本,需要知道黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属.

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案【题目】纳米级铁粉常用作食品脱氧剂,但该铁粉在空气中易自燃,需小心保存. 某课外小组同学经查阅资料,在实验室设计实验并制取食品脱氧剂,流程如图所示.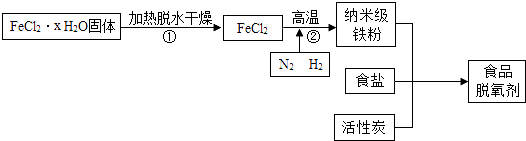
(1)①食品脱氧剂属于(填“纯净物”或“混合物”). ②过程②中,H2与FeCl2在高温下发生的是置换反应,请写出该反应的化学方程式 .
③过程②中氮气不参与反应,通入N2的目的是 .
(2)合成氨是人类科学技术上的一项重大突破,对社会发展与科技进步做出来巨大贡献.合成氨工艺的主要流程如下: 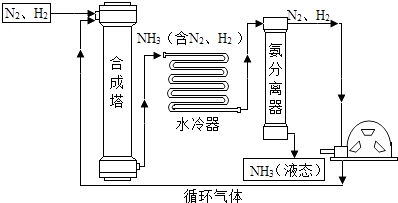
①合成塔中的反应在高温、高压、催化剂条件下进行,其化学方程式是 .
②生产过程中可循环使用的物质是 .
③根据表中的数据回答问题.
物质 | H2 | N2 | O2 | NH3 |
沸点/℃(1.01×105Pa) | ﹣252 | ﹣195.8 | ﹣183 | ﹣33.35 |
在1.01×105Pa时,欲将NH3与N2、H2分离,适宜的方法是 .