题目内容
人们的日常生活离不开金属,高科技新材料的开发和利用也需要金属。
(1)地壳中含量最高的金属元素是 。
(2)根据下图金属应用实例推断,金属具有的物理性质有 。
(1)地壳中含量最高的金属元素是 。
(2)根据下图金属应用实例推断,金属具有的物理性质有 。

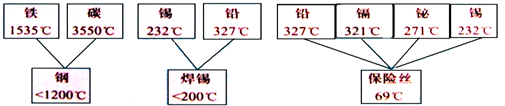
(3)日常使用的金属材料多数属于合金。现有一些合金及其组分的熔点如下:
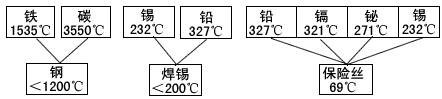
从上图中数据可以得出结论是: 。
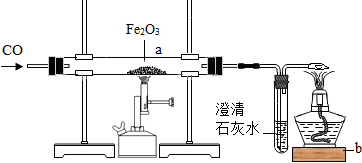
(4)钢铁是用量最大的合金。工业高炉炼铁的主要原料除铁矿石外还有 ;若选用的铁矿石是赤铁矿,请写出高炉炼铁的主要反应的化学方程式: 。
(5)某化学兴趣小组欲用Cu丝、ZnSO4溶液和AgNO3溶液进行实验来验证Zn、Cu、Ag三种金属的活动性顺序并获得成功。假如你是该小组成员,请完成下面计算:
(I)若参加反应的铜质量为3.2g,则新生成的金属质量为多少克?
(II)若反应后溶液质量为100g,则新生成的盐在溶液中的质量分数多少?
(4)钢铁是用量最大的合金。工业高炉炼铁的主要原料除铁矿石外还有 ;若选用的铁矿石是赤铁矿,请写出高炉炼铁的主要反应的化学方程式: 。
(5)某化学兴趣小组欲用Cu丝、ZnSO4溶液和AgNO3溶液进行实验来验证Zn、Cu、Ag三种金属的活动性顺序并获得成功。假如你是该小组成员,请完成下面计算:
(I)若参加反应的铜质量为3.2g,则新生成的金属质量为多少克?
(II)若反应后溶液质量为100g,则新生成的盐在溶液中的质量分数多少?
(1)铝
(2)导电性、导热性
(3)合金的熔点低于组分金属的熔点
(4)焦炭、石灰石; 3CO+Fe2O3 2Fe+3CO2
2Fe+3CO2
(5)解:设新生成的金属质量为x,新生成的盐的质量为y。
Cu+2AgNO3 === 2Ag+Cu(NO3)2
64 216 188
3.2g x y
64∶ 216 =3.2g ∶x x=10.8g
64∶ 188 =3.2g ∶y y=9.4g
新生成的盐在溶液中质量分数为:9.4g/100g×100%=9.4%
答:新生成的金属质量为10.8g;新生成的盐在溶液中的质量分数为9.4%。
(2)导电性、导热性
(3)合金的熔点低于组分金属的熔点
(4)焦炭、石灰石; 3CO+Fe2O3
 2Fe+3CO2
2Fe+3CO2 (5)解:设新生成的金属质量为x,新生成的盐的质量为y。
Cu+2AgNO3 === 2Ag+Cu(NO3)2
64 216 188
3.2g x y
64∶ 216 =3.2g ∶x x=10.8g
64∶ 188 =3.2g ∶y y=9.4g
新生成的盐在溶液中质量分数为:9.4g/100g×100%=9.4%
答:新生成的金属质量为10.8g;新生成的盐在溶液中的质量分数为9.4%。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

 人们的日常生活离不开金属,高科技新材料的开发和利用也需要金属.
人们的日常生活离不开金属,高科技新材料的开发和利用也需要金属.